
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的是
)。下列说法错误的是
A. 肉桂醛能发生加成反应、取代反应和加聚反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是()
3C+4D反应中,表示该反应速率最快的是()
A.v(A)=0.5 mol/(L·min) B.v(B)=0.3 mol/(L·min)
C.v(C)=0.8 mol/(L·min) D.v(D)=1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
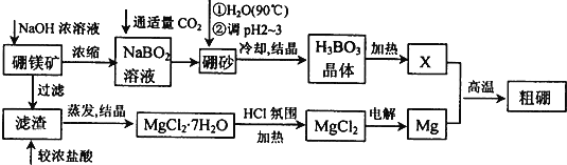
回答下列有关问题:
(1)硼砂中B的化合价为________________,溶于热水后,常用H2SO4调pH为2~3制取H3BO3,反应的离子方程式为________________________________________________________________。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_______________________________________________________________。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是______________________________________________________________。若用惰性电极电解MgCl2溶液,其总反应离子方程式为____________________________________________________________。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,则正极反应式为____________________________________________________。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定至终点,并选用指示剂,达到滴定终点的现象是_________________________________________。消耗Na2S2O3溶液18.00mL。该粗硼样品的纯度为__________________。(提示:I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是( )
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。能表明反应达到平衡状态的叙述是( )
A. 容器内的总压强不随时间变化
B. 断裂4molH—O键的同时,断裂2molH—H键
C. 混合气体分子的总数不变
D. 反应不再进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图装置的叙述不正确的是 ( )
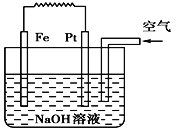
A. 这是电解NaOH溶液的装置
B. 该装置中Pt为正极,电极反应为O2+2H2O+4e- = 4OH-
C. 该装置中Fe为负极,电极反应为Fe+2OH-- 2e- = Fe(OH)2
D. 这是一个原电池装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:转化率=某一反应物转化的量÷该反应物的初始量×100%。在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论不正确的是
测定时刻/s | t1 | t2 | t3 | t4 |
c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t4时刻,该反应处于化学平衡状态
B. t3时,A的转化率比B的转化率高
C. t1至t2时刻,该反应的速率为3 mol·L-1 s-1
D. 该反应的化学方程式是:2A(g)+B(g)![]() C(g)
C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应。
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是_________(填化学式)。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
①支持甲同学观点的实验证据是______________。
②乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mL___mol/L ___溶液(填化学式)中通入SO2 | ____________ |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起到了主要作用。
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1 mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2 (无氧)溶液中通入SO2 |
向烧杯中分别加入25mL 0.1 mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(3)图1,在无氧条件下,向BaCl2溶液中持续通入SO2,溶液pH下降是因为_________(用方程式表示)。
(4)图2,BaCl2溶液中发生反应的离子方程式为___________。
(5)依据上述图像你得出的结论是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式为![]() ,它可能具有的性质是
,它可能具有的性质是
A. 它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色
B. 它既能使溴水褪色,也能使酸性高锰酸钾溶液褪色
C. 易溶于水,也易溶于有机溶剂
D. 能发生加成反应,一定条件下最多可与三倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将9g铜和铁的混合物投入100ml稀硝酸中,充分反应后得到标准状况下1.12LNO,剩余4.8g金属;继续加入100ml等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12LNO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是
A. 原混合物中铜和铁各0.065mol
B. 稀硝酸的物质的量浓度为4.0mol·L-1
C. 第一次剩余的4.8g金属为铜和铁
D. 向反应后的溶液中再加入该稀硝酸100ml,又得到的NO在标准状况下的体积为0.56L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com