
【题目】将9g铜和铁的混合物投入100ml稀硝酸中,充分反应后得到标准状况下1.12LNO,剩余4.8g金属;继续加入100ml等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12LNO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是
A. 原混合物中铜和铁各0.065mol
B. 稀硝酸的物质的量浓度为4.0mol·L-1
C. 第一次剩余的4.8g金属为铜和铁
D. 向反应后的溶液中再加入该稀硝酸100ml,又得到的NO在标准状况下的体积为0.56L
【答案】D
【解析】
A.整个过程可以看作是9g铜和铁混合物与200 mL硝酸反应生成0.1 mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为y mol,根据二者质量与生成NO的体积列方程,有:56x+64y=9、2(x+y)/3=2.24/22.4,联立方程,解得:x=0.075 mol、y=0.075 mol,A.由上述分析可知,原混合物中铜和铁各0.075 mol,故A错误;B.根据方程式可知,n(HNO3)=4n(NO)=0.4 mol,稀硝酸的物质的量浓度为0.4 mol÷0.2 L=2 mol/L,故B错误;C.9g混合物中含铁质量为0.075mol×56g/mol=4.2g,含铜质量为0.075 mol×64 g/mol=4.8 g,故第一次剩余金属4.8 g为Cu的质量,故C错误;D.再加入100mL该稀硝酸,亚铁离子与硝酸反应生成NO与硝酸铁,溶液中亚铁离子为0.075mol,根据电子转移守恒可知,亚铁离子完全反应,所以再加硝酸得NO为![]() =0.025 mol,其体积为0.025 mol×22.4 L/mol=0.56 L,故D正确;故选D。
=0.025 mol,其体积为0.025 mol×22.4 L/mol=0.56 L,故D正确;故选D。
点晴:利用整体法解答及判断最终的产物是关键,整个过程可以看作是9g铜和铁混合物与200mL硝酸反应生成0.1mol NO,金属完全溶解,向反应后的溶液中加入KSCN溶液,溶液不变红,说明生成硝酸亚铁、硝酸铜,且硝酸完全反应,发生的反应方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,设铁为x mol,铜为ymol,根据二者质量与生成NO的体积列方程,再结合选项解答。


科目:高中化学 来源: 题型:
【题目】乙醇可以发生下列反应,在反应里乙醇分子断裂H—O键的是( )
①乙醇与浓氢溴酸加热发生取代反应 ②乙醇与乙酸的酯化反应
③乙醇在浓硫酸存在下发生消去反应 ④乙醇与金属钠的反应
A. ①②B. ③④C. ①③D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·上海)离子方程式2Ca2+ + 3HCO3– + 3OH– → 2CaCO3↓ + CO32– + 3H2O可以表示( )
A.Ca(HCO3)2与NaOH溶液反应
B.NaHCO3与澄清石灰水反应
C.Ca(HCO3)2与澄清石灰水反应
D.NH4HCO3与澄清石灰水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne。下列关于20Ne和22Ne的说法正确的是( )
A.22Ne的质子数为12 B.20Ne和22Ne的中子数相同
C.20Ne和22Ne的质量数相同 D.20Ne和22Ne互为同位素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH-=2RO4n-+3Cl-+5H2O。则RO4n-中R的化合价是( )
A.3
B.4
C.5
D.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子结构图中的大黑点表示原子序数小于10的元素的“原子实”(指原子除去最外层电子的剩余部分),小黑点表示没形成共价键的最外层电子,短线表示共价键。其中分子结构图与化学式关系错误的是( )
A. ![]() (C3H4O) B.
(C3H4O) B. ![]() (HCN)
(HCN)
C. ![]() (NH3) D.
(NH3) D. ![]() (BF3)
(BF3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,16gCH4完全燃烧生成液态水时放出的热量是890.3kJ,则CH4燃烧的热化学方程式为_____________________。
(2)已知:C(s)+O2(g)=CO2(g);H=﹣437.3 kJ·mol﹣1
H2(g)+![]() O2(g)═H2O(g);H=﹣285.8 kJ·mol﹣1
O2(g)═H2O(g);H=﹣285.8 kJ·mol﹣1
CO(g)+![]() O2(g)═CO2(g);H=﹣283.0 kJ·mol﹣1
O2(g)═CO2(g);H=﹣283.0 kJ·mol﹣1
则煤气化反应C(s)+H2O(g)=CO(g)+H2(g) 的焓变H=_______kJ·mol﹣1。
(3)如图所示组成闭合回路,其中甲装置中CH4为负极,O2为正极,稀土金属材料为电极,以KOH溶液为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为400mL。

①装置中气体A为_____(填“CH4”或“O2和CO2”),d极上的电极反应式为________。
②乙装置中a极上的电极反应式为_____________。若在a极产生224mL(标准状况)气体,则甲装置中消耗CH4____mL(标准状况),乙装置中所得溶液的pH=___。(忽略电解前后溶液体秋变化)
③如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为_____(用含w、a的表达式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式__________________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素形成的单质,通常为固体,俗名是________。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的固体药品为_________,若用如图所示装置收集E气体,则应从___(填“a”或“b”)通入。
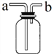
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为______,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为_____________________、_______________________、_______________________。
(5)取一定量的X晶体分解,若生成F 1mol,则必同时生成____mol___(填物质的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物在现代工业中有着广泛的用途。
(1)组成为Mg17Al12的镁铝合金是一种潜在的贮氢材料,当其贮氢最达到最大值时组成变为“17MgH2+12Al”,则Mg、Al、Mg17Al12三种物质按熔点由高到低的顺序排列为_______, 1mol“17MgH2+12Al”与足量Na0H溶液反应时生成的气体的质量是___________g。
(2)镁可与SiO2发生多种反应,且条件不同时得到的产物也不同。当二者在高温条件下发生置换反应时.还原产物是_________,若镁过量,则产物为两种镁的二元化合物,写出反应的化学方程式:______。
(3)碱式碳酸镁[MgCO3·3H2O]是重要的化工原料,下图表示的是制备它的一种工艺流程。

开始沉淀时的PH | 完全沉淀时的pH | |
Fe(OH)3 | 2.7 | 3.7 |
Mg(OH)2 | 9.7 | 11 |
① Mg9FeSi5O20中铁元素的化合价为____,pH的调节范围是______.
② 试剂a是一种常用的绿色氧化剂,加入a后反应的离子方程式为__________。
③ 写出料渣Ⅱ的一种用途:______。一般认为c(Mg2+)≤1×10-5mol/L时,Mg2+已完全沉淀,则Mg(OH)2的Ksp=______。写出生成碱式碳酸镁的离子方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com