
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,16gCH4完全燃烧生成液态水时放出的热量是890.3kJ,则CH4燃烧的热化学方程式为_____________________。
(2)已知:C(s)+O2(g)=CO2(g);H=﹣437.3 kJ·mol﹣1
H2(g)+![]() O2(g)═H2O(g);H=﹣285.8 kJ·mol﹣1
O2(g)═H2O(g);H=﹣285.8 kJ·mol﹣1
CO(g)+![]() O2(g)═CO2(g);H=﹣283.0 kJ·mol﹣1
O2(g)═CO2(g);H=﹣283.0 kJ·mol﹣1
则煤气化反应C(s)+H2O(g)=CO(g)+H2(g) 的焓变H=_______kJ·mol﹣1。
(3)如图所示组成闭合回路,其中甲装置中CH4为负极,O2为正极,稀土金属材料为电极,以KOH溶液为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为400mL。

①装置中气体A为_____(填“CH4”或“O2和CO2”),d极上的电极反应式为________。
②乙装置中a极上的电极反应式为_____________。若在a极产生224mL(标准状况)气体,则甲装置中消耗CH4____mL(标准状况),乙装置中所得溶液的pH=___。(忽略电解前后溶液体秋变化)
③如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为_____(用含w、a的表达式表示,不必化简)。
【答案】 (1)CH4(g)+2O2(g)═CO2(g)+2H2O(l) H=﹣890.3kJ·mol﹣1 (2)+131.5 (3)CH4 (4)O2+4e﹣+2CO2=2CO32﹣ (5)4OH﹣﹣4e﹣=O2↑+2H2O (6)112 (7)1 (8)![]() ×100%(2分)
×100%(2分)
【解析】(1)16g即1molCH4在氧气中燃烧生成CO2和液态水,放出889kJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31kJ/mol,故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31kJ/mol;
(2)①C(s)+O2(g)═CO2(g)△H1=-437.3kJmol-1,②H2(g)+ ![]() O2(g)═H2O(g)△H3=-285.8kJmol-1,③CO(g)+
O2(g)═H2O(g)△H3=-285.8kJmol-1,③CO(g)+ ![]() O2(g)═CO2(g)△H=-283.0kJmol-1,依据盖斯定律①-②-③,得到:C(s)+H2O(g)═CO(g)+H2(g) n△H=+131.5kJmol-1,故答案为:+131.5;
O2(g)═CO2(g)△H=-283.0kJmol-1,依据盖斯定律①-②-③,得到:C(s)+H2O(g)═CO(g)+H2(g) n△H=+131.5kJmol-1,故答案为:+131.5;
(3)①b电极上有红色物质生成,则b是阴极,所以a是阳极,c是负极、d是正极,通入甲烷的电极是负极,所以A是CH4、B是二氧化碳和氧气,d电极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-,故答案为:CH4;O2+4e-+2CO2=2CO32-;
②a是阳极,阳极上氢氧根离子放电生成氧气,电极反应式为4OH--4e-=O2↑+2H2O;a极上生成n(O2)= ![]() =0.01mol,生成0.01mol氧气转移电子物质的量=0.01mol×4=0.04mol,根据转移电子相等计算消耗甲烷体积=
=0.01mol,生成0.01mol氧气转移电子物质的量=0.01mol×4=0.04mol,根据转移电子相等计算消耗甲烷体积=![]() ×22.4L/mol=112mL;电池反应式为2Cu2++2H2O=4kH++O2↑+2Cu,根据方程式知,n(kH+)=4n(O2)=4×0.01mol=0.04mol,c(H+)=
×22.4L/mol=112mL;电池反应式为2Cu2++2H2O=4kH++O2↑+2Cu,根据方程式知,n(kH+)=4n(O2)=4×0.01mol=0.04mol,c(H+)=![]() =0.1mol/L,则溶液的pH=1,故答案为:4OH--4e-=O2↑+2H2O;112;1;
=0.1mol/L,则溶液的pH=1,故答案为:4OH--4e-=O2↑+2H2O;112;1;
③电解饱和硫酸钠溶液时,阳极上析出氧气、阴极上析出氢气,所以相当于电解水,且生成氢气和氧气的物质的量之比是2:1,所以当阴极上有a mol气体生成时,阳极上生成氧气物质的量为0.5amol,电解水的质量=amol×2g/mol+0.5amol×32g/mol=18ag,剩余溶液仍然是饱和溶液,生成m(Na2SO4)=wg×![]() ,溶液质量分数=
,溶液质量分数=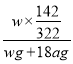 ×100%=
×100%= ×100%,故答案为:
×100%,故答案为: 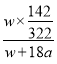 ×100%。
×100%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是

A. a处通入氧气, b处通氢气
B. 通入H2的电极发生反应:H2-2e- = 2H+
C. 通入O2的电极发生反应:O2 + 4e- + 2H2O = 4OH-
D. 该装置将化学能最终转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将9g铜和铁的混合物投入100ml稀硝酸中,充分反应后得到标准状况下1.12LNO,剩余4.8g金属;继续加入100ml等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12LNO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是
A. 原混合物中铜和铁各0.065mol
B. 稀硝酸的物质的量浓度为4.0mol·L-1
C. 第一次剩余的4.8g金属为铜和铁
D. 向反应后的溶液中再加入该稀硝酸100ml,又得到的NO在标准状况下的体积为0.56L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4﹣环己二醇是一种重要的化工原料,它可通过下列路线合成:

(1)反应⑧的反应类型是__________。
(2)有机物C按照系统命名,其名称是:_______,D中的官能团名称是______________。
(3)写出反应⑤的化学方程式为___________________________________。
(4)环己烷的一种同分异构体W,已知W分子中所有碳原子均在同一平面上,写出其结构简式_______________________,写出比W的相对分子质量少14的同系物中有顺反异构的顺式异构体的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.实验室应将钠保存在煤油中
B.分液漏斗和容量瓶在使用前都要检漏
C.可用酒精代替CCl4萃取碘水中的碘单质
D.金属镁失火不可用水来灭火
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com