
����Ŀ��A��B��C��D��E��F��G��Ϊ������Ԫ�أ�ԭ���������ε�����AԪ��ԭ�Ӻ��������ӣ�BԪ��ԭ�������������Ǵ�����������2����D�ǵؿ��к�������Ԫ�أ�E�Ļ�������ɫ��Ӧ�ǻ�ɫ��F��Gλ�����ڣ�G��ͬ����Ԫ����ԭ�Ӱ뾶��С��Ԫ�ء�
���û�ѧ����ش�
��1��D�ļ������ӵĽṹʾ��ͼ��___________��
��2���õ���ʽ��ʾE2F���γɹ���____________��
��3��E��F��G����Ԫ�����γɵļ����ӣ��뾶�ɴ�С��˳����_________>_________>_________��
��4������ʵ�������Ӧ��ʵ�������У�����ȷ����_________������ĸ����
ѡ�� | ʵ����� | ʵ������ |
a | ��E����Ͷ�뵽CuSO4��Һ�� | ���ɴ�����ɫ���� |
b | ��AlCl3��Һ��ͨ�����C����̬�⻯�� | �����ɰ�ɫ������Ȼ������ܽ� |
c | ��G�ĵ���ͨ�뵽NaBr��Һ�г�ַ�Ӧ�������Ȼ�̼�������� | �²���Һ��Ϊ��ɫ |
d | ��B�����������ͨ�뵽Na2SiO3��Һ�� | ���ɰ�ɫ���� |
��5��д��A��B�γɵ�10���ӷ��ӵĻ�ѧʽ_________����������G�ĵ����ڹ����·�Ӧ��һ��ʱ�������װ��ʾ��ͼ������ȷ��ӳʵ���������_________������ĸ����

��6����Fe��Cu�Ļ�����У�����һ������C������������Ӧ��ˮ�����ϡ��Һ����ַ�Ӧ��ʣ�����m1 g���������м���һ������ϡ���ᣬ��ַ�Ӧ��ʣ�����m2 g������˵����ȷ����_________������ĸ����
a m1����m2 b m1����m2
c ʣ����Һ��һ����Fe3+ d ʣ�������һ����Cu
���𰸡�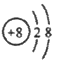
![]() S2�� C1�� Na+ ab CH4 D ad
S2�� C1�� Na+ ab CH4 D ad
��������
A��B��C��D��E��F��G��Ϊ������Ԫ�أ�ԭ���������ε�����AԪ��ԭ�Ӻ��������ӣ���AΪ��Ԫ�أ�BԪ��ԭ�Ӻ��������������Ǵ�����������2����Bԭ��ֻ����2�����Ӳ㣬�������4�����ӣ���BΪ̼Ԫ�أ�DԪ���ǵؿ��к�������Ԫ�أ���DΪ��Ԫ�أ�CԪ��ԭ����������̼����֮�䣬��CΪ��Ԫ�أ�E�Ļ�������ɫ��Ӧ�ǻ�ɫ����EΪ��Ԫ�أ�Gԭ������������Ԫ�أ����ڵ������ڣ���G��ͬ����Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ���GΪClԪ�أ�F��Gλ�����ڣ�ԭ������������Ԫ�أ���FΪ��Ԫ�أ��ݴ˷�����
A��B��C��D��E��F��G��Ϊ������Ԫ�أ�ԭ���������ε�����AԪ��ԭ�Ӻ��������ӣ���AΪ��Ԫ�أ�BԪ��ԭ�Ӻ��������������Ǵ�����������2����Bԭ��ֻ����2�����Ӳ㣬�������4�����ӣ���BΪ̼Ԫ�أ�DԪ���ǵؿ��к�������Ԫ�أ���DΪ��Ԫ�أ�CԪ��ԭ����������̼����֮�䣬��CΪ��Ԫ�أ�E�Ļ�������ɫ��Ӧ�ǻ�ɫ����EΪ��Ԫ�أ�Gԭ������������Ԫ�أ����ڵ������ڣ���G��ͬ����Ԫ����ԭ�Ӱ뾶��С��Ԫ�أ���GΪClԪ�أ�F��Gλ�����ڣ�ԭ������������Ԫ�أ���FΪ��Ԫ�ء�
��1��DΪ��Ԫ�أ���������ӵĽṹʾ��ͼ�� ��
��
��2��E2FΪNa2S�������ӻ�����õ���ʽ��ʾE2F���γɹ���Ϊ![]() ��
��
��3��E��F��G����Ԫ�����γɵļ�����Na+����������������һ�����Ӳ㣬�뾶��С��S2����C1��������ͬ���Ӳ�ṹ���˵������İ뾶��С���ʰ뾶�ɴ�С��˳����S2��>C1��>Na+��
��4��a����������Ͷ�뵽CuSO4��Һ�����Ⱥ�ˮ��Ӧ����NaOH������,NaOH��CuSO4��Ӧ����Cu(OH)2��ɫ�����Ʋ����û�������ͭ������������ɫ�������ɣ��ʲ���ȷ��
b������ͨ��AlCl3��Һ������Ӧ��AlCl3+4NH4H2O=Al��OH��3��+4NH4Cl������������Al��OH��3���ܽ⣬�ö�������ɫ�������ʲ���ȷ��
c����Cl2ͨ�뵽NaBr��Һ�г�ַ�Ӧ�������Ȼ�̼��������,Cl2�û���NaBr�е�Br2��Br2������CCl4��CCl4���Ϊ��ɫ��CCl4��ˮ���ܶȴ����²㣬����ȷ��
d��CO2ͨ�뵽Na2SiO3��Һ�в���H2SiO3�����ɰ�ɫ����������ȷ��
��ѡab��
��5��A��B�γɵ�10���ӷ��ӵĻ�ѧʽΪCH4��
CH4��Cl2�ڹ������ܹ�����ȡ����Ӧ������һϵ�е��ȴ����飨һ�ȼ��顢���ȼ��顢���ȼ��顢���Ȼ�̼�ȣ����Ȼ��⣬һ�ȼ��顢���ȼ��顢���ȼ��顢���Ȼ�̼��Ϊ������ˮ����״������Թܱ����飬���ɵ��Ȼ���������ˮ����ʹ�Թ��е���ѹ��С������ʳ��ˮ�����Թ��У���˿��Կ�����D״��������
��ѡD��
��6��HNO3����ǿ�����ԣ��ܽ�Fe��Cu����ΪFe3+��Cu2+��Fe3+���н�ǿ�������ԣ��ɽ�Fe��Cu��������һ��ʣ���������ʣ�����ΪFe��Cu����Һ�к��е�����ΪFe2+����ʣ��Cu����Һ��������ΪFe2+�����ܺ���Cu2+��������Һ�к���NO3���������������£�ʣ��Ľ�����������NO3����Ӧ�������н���ʣ�࣬����Һ��һ������Fe2+�����ܺ���Cu2+��
������������֪��m1һ������m2����a��ȷ��b����
��Ӧ���й���ʣ�࣬��һ��������Fe3+����c����
ʣ�����m2��һ�����е���Cu����d��ȷ��
��ѡad��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ�ý���ʵ�飬��Һ��A��μ��뵽����B�У�������������ȷ����
A. ��AΪŨ���ᣬBΪK2SO3��C��ʢƷ����Һ����C����Һ��ɫ
B. ��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢAlCl3��Һ����C���ȱ���Ǻ����
C. ��AΪ���ᣬBΪCaCO3��C��ʢNa2SiO3��Һ����C����Һ�б����
D. ��AΪ˫��ˮ��BΪMnO2��C��ʢNa2S��Һ����C����Һ�б����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ͼװ�õ���������ȷ���� (�� ��)
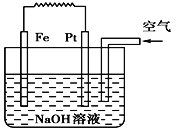
A. ���ǵ��NaOH��Һ��װ��
B. ��װ����PtΪ�������缫��ӦΪO2��2H2O��4e�� = 4OH��
C. ��װ����FeΪ�������缫��ӦΪFe��2OH��- 2e�� = Fe(OH)2
D. ����һ��ԭ���װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����ʵ�����о�SO2��Ba��NO3��2��Һ�ķ�Ӧ��
ʵ�飺��ʢ��2mL 0.1mol/L Ba��NO3��2��Һ���Թ��У�����ͨ��SO2���壬�Թ����а�ɫ����������Һ���Ϸ�����dz��ɫ��
̽��1����ɫ����������ԭ��
��1����ɫ������_________���ѧʽ����
��2��������ɫ����������ԭ��ͬѧ��Ϊ��NO3��������SO2����ͬѧ��Ϊ����Һ���ܽ��O2������SO2��
��֧�ּ�ͬѧ�۵��ʵ��֤����______________��
����ͬѧͨ������ʵ��֤�����Լ����Ʋ���ȷ�������ʵ�鷽����
ʵ����� | ʵ������ |
��2mL___mol��L ___��Һ���ѧʽ����ͨ��SO2 | ____________ |
̽��2��������SO2�Ĺ����У�NO3����O2������������Ҫ���á�
ʵ����� | ʵ������ |
���ձ��м�������˵�0.1 mol��L��BaCl2��Һ25mL���ټ���25mLֲ���ͣ���ȴ�����£���pH�������ⶨ��ҺpH��ʱ�䣨t���ı仯���� |
ͼ1����BaCl2 ����������Һ��ͨ��SO2 |
���ձ��зֱ����25mL 0.1 mol��L��BaCl2��Һ��Ba��NO3��2��Һ��ͨ��SO2����pH�������ֱ�ⶨ��ҺpH��ʱ�䣨t���仯�����ߡ� |
ͼ2���ֱ���BaCl2��Ba��NO3��2��Һ��ͨ��SO2 |
��3��ͼ1�������������£���BaCl2��Һ�г���ͨ��SO2����ҺpH�½�����Ϊ_________���÷���ʽ��ʾ����
��4��ͼ2��BaCl2��Һ�з�����Ӧ�����ӷ���ʽΪ___________��
��5����������ͼ����ó��Ľ�����_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ͻ���������¹ڲ��������ѧ���ʷ����˷dz���Ҫ���á�����˵����ȷ����
A.ҽ�þƾ�����¹ڷ��ײ�����������������
B.N95 ������ʹ�õľ۱�ϩ�������ںϳ���ά
C.Ϊ��ǿ��84������Һ������Ч�����ɵμ�Ũ����
D.�ҹ����Ƶ������¹�����������ر���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���Ľṹ��ʽΪ![]() �������ܾ��е�������
�������ܾ��е�������
A. ����ʹ��ˮ��ɫ��������ʹ���Ը��������Һ��ɫ
B. ������ʹ��ˮ��ɫ��Ҳ��ʹ���Ը��������Һ��ɫ
C. ������ˮ��Ҳ�������л��ܼ�
D. �ܷ����ӳɷ�Ӧ��һ���������������������ʵ����������ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����(����)
A. ϡ������Fe��OH��2��Һ��Ӧ��Fe��OH��2��2H��= Fe2����2H2O
B. Cl2��ˮ��Ӧ��Cl2+H2O=2H��+Cl-+ClO-
C. ̼����狀�������Ũ�ռ���Һ��ϣ�HCO3- +NH4��+2OH-=NH3��+2H2O+CO32-
D. SO2 ��Ca��ClO��2��Һ��Ӧ�� SO2 ��2ClO-+ Ca2+= CaSO3��+2HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���������CH3OCOOCH3�����DMC����һ��Ӧ��ǰ���㷺���²��������ܱ������а�n(CH3OH)��n(CO2)=2��1Ͷ��ֱ�Ӻϳ�DMC����Ӧ����ʽΪ2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g)��һ�������£�ƽ��ʱCO2��ת������ͼ��ʾ������˵������ȷ����
CH3OCOOCH3(g)+H2O(g)��һ�������£�ƽ��ʱCO2��ת������ͼ��ʾ������˵������ȷ����

A. �÷�Ӧ������ӦΪ���ȷ�Ӧ
B. ѹǿp2��p1
C. X���Ӧ��ƽ�ⳣ��Ϊ0.5
D. X��Y��Z�����Ӧ�ij�ʼ��Ӧ���ʵĹ�ϵΪZ>X>Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ��(����Ԫ����ȥ)�����ڱ��е�λ������:

(1) A��Ԫ�ط�����________��
(2) D�����ڱ��е�λ����_________________________________��
(3) E��G��T��ԭ�Ӱ뾶�ɴ�С��˳����_________(��Ԫ�ط���)��
(4)��Ԫ��(34Se)��Dͬ���壬��ǽ����Ա�D_________(����ǿ����������)����ԭ�ӽṹ�ǶȽ�����ԭ��:___________________________________________________________________��
(5) RԪ�ص�ԭ�ӽṹʾ��ͼΪ_________________��
(6) E��G��J����Ԫ������������Ӧˮ��������֮���ܷ�Ӧ�����ӷ���ʽ�ֱ�Ϊ:H+ +OH-��H2O��_________________________________��______________________��
(7) E��D��Ԫ�����γ�ԭ�Ӹ�����2:1��1:1�����ֻ����2:1 �ͻ�����ĵ���ʽΪ______________________________��1:1�ͻ�����Ļ�ѧʽ�Լ�������ѧ��������_____________________________��
(8)A��M�γɵķ��ӿ�����______________(����ĸ���)��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com