
【题目】碳酸二甲酯(CH3OCOOCH3,简称DMC)是一种应用前景广泛的新材料。在密闭容器中按n(CH3OH)∶n(CO2)=2∶1投料直接合成DMC,反应方程式为2CH3OH(g)+CO2(g)![]() CH3OCOOCH3(g)+H2O(g)。一定条件下,平衡时CO2的转化率如图所示。下列说法中正确的是
CH3OCOOCH3(g)+H2O(g)。一定条件下,平衡时CO2的转化率如图所示。下列说法中正确的是

A. 该反应的正反应为吸热反应
B. 压强p2>p1
C. X点对应的平衡常数为0.5
D. X、Y、Z三点对应的初始反应速率的关系为Z>X>Y
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量变化关系的描述中,说法不正确的是 ( )
A. 化学反应中,吸热反应不一定需要加热也能发生
B. 化学反应中一定有能量变化
C. 放热的反应,不必加热就能发生反应
D. 热化学反应方程式中,热效应数值与反应物的物质的量多少有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E的化合物焰色反应是黄色,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)D的简单阴离子的结构示意图是___________。
(2)用电子式表示E2F的形成过程____________。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是_________>_________>_________。
(4)下列实验操作对应的实验现象中,不正确的是_________(填字母)。
选项 | 实验操作 | 实验现象 |
a | 将E单质投入到CuSO4溶液中 | 生成大量红色固体 |
b | 向AlCl3溶液中通入过量C的气态氢化物 | 先生成白色沉淀,然后沉淀溶解 |
c | 将G的单质通入到NaBr溶液中充分反应后,加入四氯化碳,振荡,静置 | 下层溶液变为橙色 |
d | 将B的最高价氧化物通入到Na2SiO3溶液中 | 生成白色沉淀 |
(5)写出A与B形成的10电子分子的化学式_________,该物质与G的单质在光照下反应,一段时间后,下列装置示意图中能正确反映实验现象的是_________(填字母)。

(6)在Fe和Cu的混合物中,加入一定量的C的最高价氧化物对应的水化物的稀溶液,充分反应后剩余金属m1 g,再向其中加入一定量的稀硫酸,充分反应后剩余金属m2 g。下列说法正确的是_________(填字母)。
a m1大于m2 b m1等于m2
c 剩余溶液中一定有Fe3+ d 剩余金属中一定有Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是
A. 将少量FeCl2溶液加入到NaOH溶液中,再滴加H2O2溶液
B. 将少量AgNO3溶液滴加到NaBr溶液中,再滴加Na2S溶液
C. 将少量CO2(g)通入饱和Ca(OH)2溶液中,再通入过量Cl2(g)
D. 将少量Ba(OH)2溶液滴加到入A12(S04)3溶液中,再加入过量NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容绝热密闭容器中,对于反应A(g)+B(g) ![]() 3C(g)(正反应为放热反应),下述为平衡状态标志的是)
3C(g)(正反应为放热反应),下述为平衡状态标志的是)
①单位时间内A、B生成C的分子数与C分解的分子数相等 ②外界条件不变时,A、B、C浓度不随时间变化 ③体系温度不再变化 ④体系的压强不再变化 ⑤体系的分子总数不再变化
A. ①② B. ①②③ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下各种说法:
①金属和非金属化合时一定形成离子键;
②离子键是阳离子、阴离子的相互吸引力;
③根据电离方程式HCl![]() H++Cl-,判断氯化氢分子里存在离子键;
H++Cl-,判断氯化氢分子里存在离子键;
④氢气和氯气的反应过程:H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程
上述各种说法正确的是
A. ①② B. 都不正确 C. ①②④ D. ①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

(1)B极上的电极反应式为___________________________。
(2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,则电解时阳极的反应式为_______________________________________,当阳极收集到11.2L(标准状况)气体时,消耗甲醇的质量为__________克(保留两位有效数字),若要使溶液复原,可向电解后的溶液中加入的物质有 ___________。
(3)目前已开发出用电解法制取ClO2的新工艺。
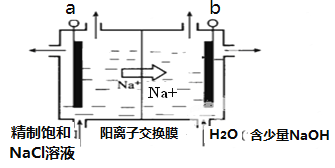
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。若用上述甲醇燃料电池进行电解,则电解池的电极a接甲醇燃料电池的________极(填A或B),写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活中用途比较广泛。
(1)高铁酸钠(Na2FeO4)是一种新型的绿色消毒剂和高容量电池材料。将Fe(NO3)3与NaClO混合后,在碱性条件下发生反应可制得高铁酸钠,该反应的离子方程式为_____________________________________。
(2)四氧化三铁(Fe3O4)常用作颜料、磁流体材料、催化剂和电子材料等。共沉淀法是目前制备纳米Fe3O4的重要方法之一,其流程如图所示:
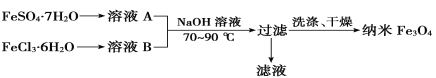
①为得到较纯净的纳米Fe3O4,FeSO4·7H2O与FeCl3·6H2O的物质的量之比最好为________。但实际操作时,却很难控制这一比例,原因是___________________________________________。
②在最佳投料比条件下,检验Fe3O4是否沉淀完全的实验操作是_________________________。
(3)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。测定绿矾产品中FeSO4·7H2O含量的方法如下:
a.称取3.0 g绿矾产品,配制成250.00 mL溶液;
b.量取25.00 mL a中溶液于锥形瓶中;
c.用0.01000 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液的平均体积为20.00 mL。滴定时发生反应的离子方程式为5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O。
①滴定终点的现象是_______________________________________________________________________。
②产品中FeSO4·7H2O的质量分数为________(小数点后保留1位数字)。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),可能的原因有________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应:I2(g)+H2(g) ![]() 2HI(g)(正反应吸热)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中所列出的条件,其他条件不变,试将化学反应速率的改变(“增大”、“减小”或“不变”)填入相应的表格。
2HI(g)(正反应吸热)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中所列出的条件,其他条件不变,试将化学反应速率的改变(“增大”、“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
(1) | 降低温度 | ____________ |
(2) | 加入催化剂 | _____________ |
(3) | 再充入a mol H2 | _____________ |
(4) | 将容器容积扩大为原来2倍 | ___________ |
(5) | 通入b mol Ne(g) | __________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com