
【题目】(1)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4﹕5,其中FeO、Fe2O3的物质的量之比为__________。
②当催化剂中+2价铁与+3价铁的物质的量之比为1﹕2时,其催化活性最高,此时铁的氧化物的混合物中铁的质量分数为 _______________。 (用小数表示,保留2位小数)。
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①用FeO、Fe2O3和稀盐酸、氯气制取FeCl3溶液的离子方程式为________________________、______________________________、______________________________。检验溶液中Fe3+存在的试剂是_______________。
②写出FeCl3溶液与金属铜发生反应的化学方程式_____________________________,当转移电子数为6.02×1024时,被氧化的物质的质量为_______________。
【答案】2﹕1 0.72 FeO+2H+=Fe2++H2O Fe2O3+6H+=2Fe3++3H2O 2Fe2++Cl2=2Fe3++2Cl- KSCN溶液 2FeCl3+Cu=2FeCl2+CuCl2 320 g
【解析】
(1) ①根据元素守恒计算FeO、Fe2O3的物质的量比。
②根据化合价代数和等于0计算铁、氧原子的物质的量之比;
(2)①FeO与盐酸反应生成氯化亚铁和水,Fe2O3与盐酸反应生成氯化铁和水,氯化亚铁被氯气氧化为氯化铁;Fe3+遇KSCN溶液显红色;
②FeCl3溶液与金属铜反应生成氯化亚铁和氯化铜。
(1) ①设FeO、Fe2O3的物质的量分别是xmol、ymol;则![]() ;
;![]() ,FeO、Fe2O3的物质的量之比为2﹕1;
,FeO、Fe2O3的物质的量之比为2﹕1;
②+2价铁的物质的量是xmol,则+3价铁的物质的量为2xmol,根据化合价代数和等于0,O原子的物质的量是![]() 4xmol,铁、氧原子的物质的量之比3x:4x=3:4,铁的质量分数为
4xmol,铁、氧原子的物质的量之比3x:4x=3:4,铁的质量分数为![]() 0.72;
0.72;
(2)①FeO与盐酸反应生成氯化亚铁和水,Fe2O3与盐酸反应生成氯化铁和水,氯化亚铁被氯气氧化为氯化铁,反应的离子方程式依次为FeO+2H+=Fe2++H2O 、 Fe2O3+6H+=2Fe3++3H2O 、 2Fe2++Cl2=2Fe3++2Cl-;Fe3+遇KSCN溶液显红色,检验溶液中Fe3+存在的试剂是KSCN溶液;
②FeCl3溶液与金属铜反应生成氯化亚铁和氯化铜,反应的化学方程式是2FeCl3+Cu=2FeCl2+CuCl2; Cu的化合价由0升高为+2,6.02×1024个电子的物质的量是10mol,被氧化的铜的物质的量是5mol,质量是5mol×64g/mol= 320 g 。


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】下列浓度关系正确的是
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,在自然界主要以化合态的形式存在于氧化铝中。铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,冶炼金属铝很重要的一个过程是Al2O3的提纯。由于Al2O3是两性氧化物,而杂质SiO2是酸性氧化物,Fe2O3是碱性氧化物,下图为工业上用酸溶法提取铝土矿中的铝。
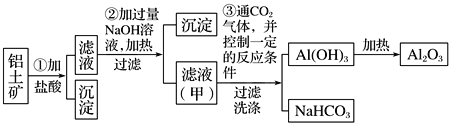
回答下列问题:
(1)①中加盐酸后的沉淀主要是___________(化学式),为了加快铝土矿在盐酸中的溶解,可采取的措施有___________________________(一种即可)。
(2)写出③中可能发生反应的离子方程式。
③_____________________、________________________。
(3)步骤②中不用氨水沉淀Fe3+的原因:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知过氧化氢在强碱性溶液中主要以HO2-存在。我国研究的Al-H2O2燃料电池可用于深海资源的勘查、军事侦察等国防科技领域,装置示意图如下。下列说法错误的是
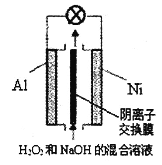
A. 电池工作时,溶液中OH-通过阴离子交换膜向Al极迁移
B. Ni极的电极反应式是HO2-+2e-+H2O=3OH-
C. 电池工作结束后,电解质溶液的pH降低
D. Al电极质量减轻13.5g,电路中通过9.03×1023个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,过量摄入能致癌。酸性KMnO4 溶液与NaNO2反应的方程式是MnO4-+NO2-+![]() ―→Mn2++NO3-+H2O。下列叙述中正确的是
―→Mn2++NO3-+H2O。下列叙述中正确的是
A. 该反应中NO2-被还原
B. 反应过程中溶液的pH增大
C. 生成1 mol NaNO3需消耗0.2 mol KMnO4
D. ![]() 中的粒子是OH-
中的粒子是OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量之比为16:7:6的三种气体SO2、CO、NO,分子个数之比为________;氧原子个数之比为________;相同条件下的体积之比为________。
(2)标准状况下,1.7 g NH3的体积为________L,它与标准状况下________L H2S含有相同数目的氢原子。
(3)某气体氧化物的化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为______,R的相对原子质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业金属钛冶炼过程中有一步将原料金红石转化,其反应方程式为:TiO2(金红石)+2C+2Cl2=TiCl4+2CO
已知:
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141kJ·mol-1;
(1)CO的燃烧热是___。
(2)请写出金红石转化的热化学方程式___。
II.如图所示的三套实验装置中,甲、乙两套装置的电池反应均为Zn+Cu2+=Zn2++Cu,盐桥内装有含琼脂的饱和KCl溶液,回答下列有关问题:
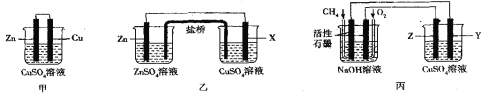
(1)甲装置中铜电极上的电极反应式为___。
(2)放电时盐桥中的Cl-将会出现在乙装置__(填“左”或“右”)侧的容器中,X电极的成分不可能是__(填字母)
a.铜 b.铁 c.石墨 d.铝
(3)用丙装置在铁上镀铜,则电极材料为铁的是__(填“Y或Z”),负极上的电极反应式为___。
(4)当丙池中某电极的质量减少1.6g时,则消耗的O2在标况下的体积是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是___(填编号)。
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(2)写出软锰矿浆吸收SO2 的离子方程式___。
(3)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是___。
(4)写出KMnO4与MnSO4溶液反应的离子方程式___。
(5)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式___。
(6)除杂后得到的MnSO4溶液可以通过___(填操作名称)、过滤制得硫酸锰晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com