
【题目】NaNO2是一种食品添加剂,过量摄入能致癌。酸性KMnO4 溶液与NaNO2反应的方程式是MnO4-+NO2-+![]() ―→Mn2++NO3-+H2O。下列叙述中正确的是
―→Mn2++NO3-+H2O。下列叙述中正确的是
A. 该反应中NO2-被还原
B. 反应过程中溶液的pH增大
C. 生成1 mol NaNO3需消耗0.2 mol KMnO4
D. ![]() 中的粒子是OH-
中的粒子是OH-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z。下列说法中正确的是( )
A. Z是共价化合物
B. Z可表示为M2Y
C. Z的电子式可表示为 ![]()
D. M形成+2价阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,工业上由铬铁矿(主要成分为FeO·Cr2O3、SiO2等)制备,制备流程如图所示:
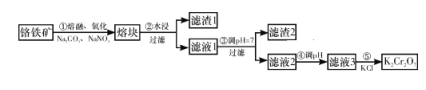
已知:
Ⅰ.步骤①的主要反应为2FeO·Cr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
Ⅱ.2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
下列说法正确的是( )
A. 步骤①熔融、氧化可以在陶瓷容器中进行
B. 步骤①中每生成44.8 L CO2共转移7 mol电子
C. 步骤④若调节滤液2的pH,使之变小,则有利于生成Cr2O72-
D. 步骤⑤生成K2Cr2O7晶体,说明该温度下K2Cr2O7的溶解度大于Na2Cr2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应过程中的先后顺序,下列评价正确的是
A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室处理废催化剂FeBr3溶液,得到溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是
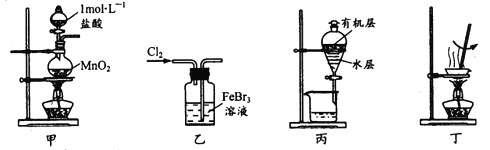
A.用装置甲制取氯气
B.用装置乙使Br-全部转化为溴单质
C.用装置丙分液时先从下口放出水层,再从上口倒出有机层
D.用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4﹕5,其中FeO、Fe2O3的物质的量之比为__________。
②当催化剂中+2价铁与+3价铁的物质的量之比为1﹕2时,其催化活性最高,此时铁的氧化物的混合物中铁的质量分数为 _______________。 (用小数表示,保留2位小数)。
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①用FeO、Fe2O3和稀盐酸、氯气制取FeCl3溶液的离子方程式为________________________、______________________________、______________________________。检验溶液中Fe3+存在的试剂是_______________。
②写出FeCl3溶液与金属铜发生反应的化学方程式_____________________________,当转移电子数为6.02×1024时,被氧化的物质的质量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常用的食品添加剂,使用时需严格控制用量。实验室以2NO+Na2O2=2NaNO2为原理,利用下列装置制取NaNO2(夹持和加热仪器略)。
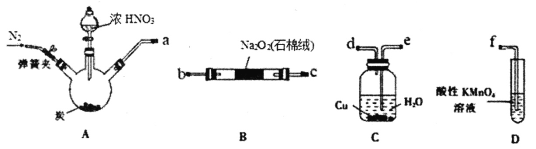
已知:①酸性KMnO4溶液可将NO及NO2-氧化为NO3-,MnO4-被还原为Mn2+。
②HNO2具有不稳定性:2HNO2=NO2↑+NO↑+H2O。
回答下列问题:
(1)按气流方向连接仪器接口______________(填接口字母)。
(2)实验过程中C装置内观察到的现象是___________________________。
(3)Na2O2充分反应后,测定NaNO2含量:称取反应后B中固体样品3.45g溶于蒸馏水,冷却后用0.50mol· L-1酸性KMnO4标准液滴定。重复三次,标准液平均用量为20.00mL。
①该测定实验需要用到下列仪器中的___________(填序号)。
a.锥形瓶 b.容量瓶 c.胶头滴管 d.酸式滴定管 e.碱式滴定管 f.玻璃棒
②假定其他物质不与KMnO4反应,则固体样品中NaNO2的纯度为____%。
③实验得到NaNO2的含量明显偏低,分析样品中含有的主要杂质为_____(填化学式)。为提高产品含量,对实验装置的改进是在B装置之前加装盛有_____(填药品名称)的______(填仪器名称)。
(4)设计一个实验方案证明酸性条件下NaNO2具有氧化性________________________。
(提供的试剂:0.10mol·L-1NaNO2溶液、KMnO4溶液、0.10mol·L-1KI溶液、淀粉溶液、稀硝酸、稀硫酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表列出了A~R9种元素在周期表中的位置,用化学用语回答:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)这九种元素中化学性质最不活泼的是___。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是__。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为__。
(4)F、G、H三种元素简单氢化物沸点由高到低的顺序__。/p>
(5)E元素氧化物的电子式是__,F的氢化物在常温下跟B反应的化学方程式是__。
(6)下列事实能用元素周期律解释的是(填字母序号)__。
A.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.G的气态氢化物的稳定性弱于HF
C.FeG3的溶液可用于刻蚀铜制的印刷电路板
(7)G的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl、SO42、CO32离子。现进行以下实验:
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有_________________________;
肯定不存在的离子有___________________________。
②写出C中发生反应的离子方程式________________________________。
(2)①还原铁粉与高温水蒸气反应的化学方程式:_____________________________;
②除去Mg粉中的Al粉的试剂是__________________,反应的离子方程式为:___________________________________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+_____ _______
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;
当有2mol H3PO4生成,转移的电子的物质的量为__________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com