
【题目】如表列出了A~R9种元素在周期表中的位置,用化学用语回答:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)这九种元素中化学性质最不活泼的是___。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是__。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为__。
(4)F、G、H三种元素简单氢化物沸点由高到低的顺序__。/p>
(5)E元素氧化物的电子式是__,F的氢化物在常温下跟B反应的化学方程式是__。
(6)下列事实能用元素周期律解释的是(填字母序号)__。
A.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.G的气态氢化物的稳定性弱于HF
C.FeG3的溶液可用于刻蚀铜制的印刷电路板
(7)G的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因:_____。
【答案】Ar Al(OH)3+OH-=AlO2-+2H2O K>Na>Mg H2O>HBr>HCl ![]() 2K+2H2O=2KOH+H2↑ AB 最外层电子数相同,Br的原子半径大,得到电子能力比Cl弱,非金属性Cl大于Br
2K+2H2O=2KOH+H2↑ AB 最外层电子数相同,Br的原子半径大,得到电子能力比Cl弱,非金属性Cl大于Br
【解析】
由元素在周期表的位置可知,A是Na,B是K,C是Mg,D是Al,E是C,F是O,G是Cl,H是Br,R是Ar,结合原子结构和元素周期律分析解答。
由元素在周期表的位置可知,A是Na,B是K,C是Mg,D是Al,E是C,F是O,G是Cl,H是Br,R是Ar。
(1)元素周期表中化学性质最不活泼是稀有气体元素,即Ar的性质最不活泼,故答案为:Ar;
(2)铝元素最高价氧化物对应的水化物为氢氧化铝,氢氧化铝是两性氢氧化物,能与氢氧化钠反应,反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)一般而言,电子层越多,半径越大,所以K的半径最大,电子层数相同时,原子序数越小,半径越大,则Na>Mg,所以原子半径大小为K>Na>Mg,故答案为:K>Na>Mg;
(4)H2O分子间存在氢键,沸点最高;HCl和HBr都是分子晶体,相对分子量越大,沸点越高,则沸点:HBr>HCl,所以沸点高低为:H2O>HBr>HCl,故答案为:H2O>HBr>HCl;
(5)E为C元素,其氧化物若为二氧化碳,属于共价化合物,其电子式为![]() ;F是O,氢化物为水,K与水反应生成氢氧化钾和氢气,化学反应方程式为:2K+2H2O=2KOH+H2↑,故答案为:
;F是O,氢化物为水,K与水反应生成氢氧化钾和氢气,化学反应方程式为:2K+2H2O=2KOH+H2↑,故答案为:![]() ;2K+2H2O=2KOH+H2↑;
;2K+2H2O=2KOH+H2↑;
(6)A.金属性越强,对应最高价氧化物对应水化物的碱性越强,金属性:Al<Mg,则碱性:Al(OH)3<Mg(OH)2,可用元素周期律解释,故A选;B.非金属性越强,对应氢化物越稳定,稳定性:HCl<HF,可用元素周期律解释,故B选;C.Cu与氯化铁发生氧化还原反应,与元素周期律无关,不能用元素周期律解释,故C不选;故答案为:AB;
(7)G的单质可以从NaBr溶液中置换出Br2单质,因为Cl和Br的最外层电子数相同,Br的原子半径大,得到电子能力比Cl弱,非金属性Cl大于Br,故答案为:最外层电子数相同,Br的原子半径大,得到电子能力比Cl弱,非金属性Cl大于Br。


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,下列判断正确的是( )
A.4.8g金属镁变为Mg2+时失去的电子数为0.2NA
B.6.2gNa2O中含有的阴离子数为0.1NA
C.1molCl2参加反应转移电子数一定为2NA
D.含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaNO2是一种食品添加剂,过量摄入能致癌。酸性KMnO4 溶液与NaNO2反应的方程式是MnO4-+NO2-+![]() ―→Mn2++NO3-+H2O。下列叙述中正确的是
―→Mn2++NO3-+H2O。下列叙述中正确的是
A. 该反应中NO2-被还原
B. 反应过程中溶液的pH增大
C. 生成1 mol NaNO3需消耗0.2 mol KMnO4
D. ![]() 中的粒子是OH-
中的粒子是OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )

选项 | 气体 | a | b | c | d |
A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO溶液 | 浓硫酸 |
B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 固体NaOH |
D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.已知CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1,则甲烷的燃烧热为893.0kJ·mol-1
B.已知4P(红磷,s)=P4(白磷,s);ΔH>0,则白磷比红磷稳定
C.含20.0gNaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,反应的热化学方程式为:NaOH(aq)+![]() H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH=-57.4kJ·mol-1
H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH=-57.4kJ·mol-1
D.己知C(s)+O2(g)=CO2(g);ΔH1 C(s)+![]() O2(g)=CO(g);ΔH2,则ΔH1>ΔH2
O2(g)=CO(g);ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业金属钛冶炼过程中有一步将原料金红石转化,其反应方程式为:TiO2(金红石)+2C+2Cl2=TiCl4+2CO
已知:
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141kJ·mol-1;
(1)CO的燃烧热是___。
(2)请写出金红石转化的热化学方程式___。
II.如图所示的三套实验装置中,甲、乙两套装置的电池反应均为Zn+Cu2+=Zn2++Cu,盐桥内装有含琼脂的饱和KCl溶液,回答下列有关问题:
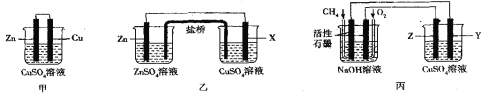
(1)甲装置中铜电极上的电极反应式为___。
(2)放电时盐桥中的Cl-将会出现在乙装置__(填“左”或“右”)侧的容器中,X电极的成分不可能是__(填字母)
a.铜 b.铁 c.石墨 d.铝
(3)用丙装置在铁上镀铜,则电极材料为铁的是__(填“Y或Z”),负极上的电极反应式为___。
(4)当丙池中某电极的质量减少1.6g时,则消耗的O2在标况下的体积是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用铜跟浓硫酸反应,探究SO2的部分性质,实验装置如图所示。
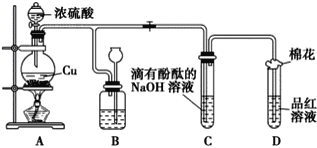
(1)装置A中发生的化学反应的化学方程式为________________________________
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是________(填序号);
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有____________性
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是____________
(5)若实验中用一定质量的铜片和25.0 mL 18.0 mol·L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为d mol·L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾____________mol(用含d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现以CO、O2、熔融盐Z(Na2CO3)组成的燃料电池,采用电解法处理CO同时制备N2O5,装置如图所示,其中Y为CO2。下列说法不合理的是
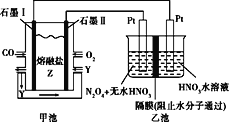
A.石墨Ⅰ是原电池的负极,发生氧化反应
B.甲池中的CO32-向石墨Ⅱ极移动
C.石墨Ⅰ的电极反应式:CO+CO32--2e-=2CO2
D.若甲池消耗标准状况下的氧气2.24L,则乙池中产生氢气0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关容量瓶和分液漏斗的使用,正确的是( )

A.使用容量瓶前必须对其进行干燥
B.把混合液体转移至分液漏斗,塞上玻璃塞,如图所示用力振荡
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.定容后,盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com