
【题目】(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表。
锌片上发生的电极反应:__________________;银片上发生的电极反应:_________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况)___________L;
②通过导线的电量________C。(已知NA=6.02×1023mol-1,电子电荷为1.60×10-19C)
【答案】 Zn-2e-===Zn2+ 2H++2e-===H2↑ 4.48 L 3.85×104
【解析】(1)将锌片和银片浸入稀硫酸中组成原电池,锌做负极,失电子发生氧化反应,电极反应为:Zn-2e-═Zn2+,银片做正极,溶液中氢离子在银电极得到电子发生还原反应,电极反应为:2H++2e-═H2↑;
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,分析可知电极质量减小的是负极反应的锌的质量,物质的量=![]() =0.2mol;
=0.2mol;
①锌做负极,失电子发生氧化反应,电极反应为:Zn-2e-═Zn2+,银片做正极,溶液中氢离子在银电极得到电子发生还原反应,电极反应为:2H++2e-═H2↑,依据电子守恒可知,转移电子物质的量为0.4mol,生成氢气物质的量为0.2mol,标准状况下体积=0.2mol×22.4L/mol=4.48L;
②依据计算得到转移电子物质的量为0.4mol,换算为电量=0.4mol×6.02×1023/mol×1.60×10-19C=3.85×104C。


 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】为了有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物含量、使用清洁能源显得尤为重要。
(1)已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) H = -905.48 kJ·mol-1
4NO(g)+6H2O(g) H = -905.48 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) H = +180.50 kJ·mol-1
2NO(g) H = +180.50 kJ·mol-1
则4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)的H = 。
5N2(g)+6H2O(g)的H = 。
(2)某化学小组查阅资料知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g)![]() N2O2(g) (快) H1<0 v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0 v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)![]() 2NO2(g) (慢) H2< 0
2NO2(g) (慢) H2< 0
v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
① 2NO(g)+O2(g)![]() 2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由_______(填“第一步”或“第二步”)反应决定。
② 一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ;升高温度,K值 (填“增大”、“减 小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K= ;升高温度,K值 (填“增大”、“减 小”或“不变”)
(3)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)![]() N2(g)+xCO2(g) △H <0;理论上,适当增加汽车排气管(内壁为活性炭涂层)长度______(填“能”或“不能”)使NOx更加有效地转化为无毒尾气而排放,其原因是 。
N2(g)+xCO2(g) △H <0;理论上,适当增加汽车排气管(内壁为活性炭涂层)长度______(填“能”或“不能”)使NOx更加有效地转化为无毒尾气而排放,其原因是 。
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应: C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示,则800℃时,反应达平衡时CO2的转化率为________(保留一位小数)。
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示,则800℃时,反应达平衡时CO2的转化率为________(保留一位小数)。

(5)氢气是一种重要的清洁能源,Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(g)。经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1。其中正确的是
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
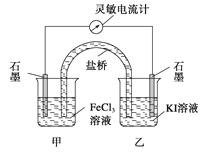
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上的Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.在熔融状态下,1molNa2O2完全电离出的离子数目为4 NA
B.常温下,0.05molCO2和SO2混合气体中所含氧原子数为0.1 NA
C. 0.1 mol·L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
D.0.1 mol MnO2与足量的浓盐酸加热反应生成Cl2的体积约为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 高纯度的晶体硅可以制备晶体管等半导体、电脑芯片和光导纤维
B. PM 2.5是指大气中直径接近2.5×10-6 m的颗粒物,它分散在空气中形成胶体
C. 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理
D. NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中, 分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )

A. c点,两溶液中含有相同量的OH- B. b点,溶液中大量存在的离子是Na+、OH-
C. ①代表滴加H2SO4溶液的变化曲线 D. a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【选修5:有机化学基础】化合物E是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:

(1)E中的含氧官能团名称为 。
(2)B转化为C的反应类型是 。
(3)写出D与足量NaOH溶液完全反应的化学方程式 。
(4)1molE最多可与 molH2加成。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式 。
A.苯环上只有两个取代基,且除苯环外无其他环状结构
B.核磁共振氢谱只有4个峰
C.能与FeCl3溶液发生显色反应
(6)已知:酚羟基一般不易直接与羧酸酯化,甲苯可被酸性高锰酸钾溶液氧化为苯甲酸。试参照如下和成路线图示例写出以苯酚、甲苯为原料制取苯甲酸苯酚酯(![]() )的合成路线(无机原料任选)。合成路线流程图示例如下:
)的合成路线(无机原料任选)。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如右下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com