
【题目】下列自然资源的开发利用中,不涉及化学变化的是:
①石油的分馏;②煤的干馏;③将石油催化裂解生产乙烯;④用铝热反应焊接钢轨;⑤用乙烯制取聚乙烯;⑥用铁矿石冶炼铁;⑦乙烯做植物生长调节剂和果实催熟剂;⑧用蒸馏法从海水制取淡水;⑨用食醋清除暖水瓶中的水垢;⑩将干冰放在通风处自然升华
A. ①②③④ B. ①②⑤⑦ C. ①⑧⑩ D. ①②⑥⑨ ![]()
【答案】C
【解析】
①石油的分馏,利用沸点不同分离互溶液体的方法,不涉及化学变化;②煤的干馏是隔氧加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程。属于化学变化;③将石油催化裂解生产乙烯,属于化学变化;④用铝热反应焊接钢轨属于化学变化;⑤用乙烯制取聚乙烯化学变化;⑥用铁矿石冶炼铁属于化学变化;⑦乙烯做植物生长调节剂和果实催熟剂,不属于物理变化;⑧用蒸馏法从海水制取淡水,属于物理变化;⑨用食醋清除暖水瓶中的水垢,化学变化;⑩将干冰放在通风处自然升华物理变化。根据上述分析A. ①②③④不符合题意, B. ①②⑤⑦不符合题意;C. ①⑧⑩符合题意;D. ①②⑥⑨不符合题意。答案:C。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛,下列说法正确的是( )
A.制取普通玻璃是以纯碱、黏土、石英砂为主要原料
B.二氧化硅是太阳能转换为电能的常用材料
C.石棉(CaMg3Si4O12)表示为CaO·3MgO·4SiO2
D.水晶、玻璃、陶瓷的主要成分都属于硅酸盐制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
四 | ⑨ | ⑩ |
(1)在这些元素中,⑩最高价氧化物的水化物为__________。
(2)写出①的最高价氧化物和②的单质的电子式_________,________。
(3)用电子式表示③与④形成化合物的过程______________________。
(4)①的单质和⑥的氧化物反应的化学方程式______________________。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:________________________写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:_____________________。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+的电子层结构与Ne相同,Z的质子数为偶数,室温下M的单质为淡黄色固体,下列有关说法正确的是( )
A.Y单质能在X的最高价氧化物中燃烧,发生置换反应
B.X、Z、M的最简单气态氢化物的热稳定性依次增强
C.X、Y、Z、M的原子半径依次减小
D.化合物![]() 的熔点高于化合物YM的熔点
的熔点高于化合物YM的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?)2HI(g)△H=-9.48kJmol-1
②H2(g)+I2(?)2HI(g)△H=+26.48kJmol-1
下列判断不正确的是( )
A.![]() 中的I2为气态,
中的I2为气态,![]() 中的I2为固态
中的I2为固态
B.![]() 的反应物总能量比
的反应物总能量比![]() 的反应总能量低
的反应总能量低
C.1mol固态碘升华时将吸热35.96kJ
D.反应![]() 的产物比反应
的产物比反应![]() 的产物热稳定性更好
的产物热稳定性更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与工农业生产和人类生活密切相关。下列说法中不正确的是( )
A.明矾[KAl(SO4)2·12H2O]可用作净水剂
B.海轮外壳上镶入锌块,可减缓船体的腐蚀
C.聚氯乙烯塑料袋可用于包装食品
D.减少化石燃料使用,有利于降低空气中PM2.5(直径2.5μm以下细颗粒物)的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是
A.Na+、K+、HCO3、NO3 B.NH4+、SO42、Al3+、NO3
C.Na+、Ca2+、NO3、CO32 D.K+、MnO4、NH4+、NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.NO是第一个被发现的生命体系气体信号分子,具有舒张血管的功能。工业上可用“氨催化氧化法”生产NO,主要副产物为N2。请回答下列问题:
(1)以氨气、氧气为原料,在催化剂存在下生成NO和副产物N2的热化学方程式如下:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H1①,4NH3(g)+3O2(g)
4NO(g)+6H2O(g) △H1①,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H2②,N2(g)+O2(g)
2N2(g)+6H2O(g) △H2②,N2(g)+O2(g)![]() 2NO(g) △H3③,则上述反应热效应之间的关系式为△H3 =___________________。
2NO(g) △H3③,则上述反应热效应之间的关系式为△H3 =___________________。
(2)某化学研究性学习小组模拟工业合成NO的反应。在1110K时,向一恒容密闭容器内充入1mol NH3和2.8mol O2,加入合适催化剂(催化剂的体积大小可忽略不计),保持温度不变,只发生反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H<0。
4NO(g)+6H2O(g) △H<0。
①下列各项能说明反应已达到化学平衡状态的是_______。(填字母序号)
a.5c(NH3)=4c(O2)
b.N-H键的生成速率与O-H键的生成速率相等
c.混合气体的压强不变
d.混合气体的密度不变
②若其他条件不变,将容器改为恒容的绝热容器,在达到平衡后的体系温度下的化学平衡常数为K1,则K1_____K(填“>”、“<”或“=”)。
II.(3)某化学研究性学习小组模拟用CO和H2合成甲醇,其反应为:CO(g)+2H2(g) ![]() CH3OH(g)△H<O。在容积固定为1L的密闭容器内充入2mol CO和4 mol H2,加入合适的催化剂(体积可以忽略不计)、保持250℃不变发生上述反应,用压力计监测容器内压强的变化如下:
CH3OH(g)△H<O。在容积固定为1L的密闭容器内充入2mol CO和4 mol H2,加入合适的催化剂(体积可以忽略不计)、保持250℃不变发生上述反应,用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_______,该温度下平衡常数K=_______。
III.(4)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极上的电极反应式为_____________。
②若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,当阳极收集到5.6 L(标准状况)气体时,消耗甲烷的体积为________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
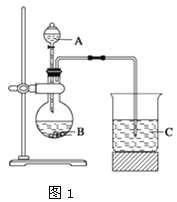
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。利用上述装置图1一次性完成Cl、C、Si三种非金属元素的非金属性强弱比较的实验研究。
(1)实验中选用的物质名称为:A____________,B__________,C____________;
(2)C处反应的离子方程式为________________。
(3)根据实验现象推知,可得出碳、硅、氯三种元素非金属性的强弱顺序是_____。
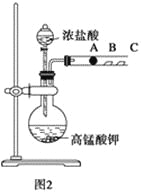
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气和Mn2+,利用上述装置图2探究卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。
(4)写出圆底烧瓶中发生反应的离子方程式:____________________。
(5)B处的实验现象为______________________________________________。
(6)根据A、B两处的实验现象能否推出非金属性Cl>Br>I,____(填“能”或“否”),原因________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com