

| ||
| ||
| ||
| ||
| 87.7mg×146 |
| 100mg |
| 68.5g×146 |
| 100mg |
| ||
| ||
| ||
| ||
| 38mg |
| 100mg |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图2 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
| 508000b |
| a |
| 508000b |
| a |
查看答案和解析>>
科目:高中化学 来源: 题型:
126 53 |
127 53 |
128 53 |
131 53 |

- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源:2010届江苏启东中学高三考前辅导训练化学试题 题型:填空题
(Ⅰ)2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
(1)图中A表示 。
(2)E的大小对该反应的焓变有无影响? 。
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? 。
(3)某温度下,向1L密闭容器中开始充入2molSO2和1molO2,在V2O5催化剂存在时反应达到平衡,压强减小为开始时的 ;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)
;如在相同温度下,在同等体积的密闭容器中充入2mol的SO3,也在V2O5催化剂存在时反应达到平衡,求此温度下反应2SO3 (g)  2SO2(g) + O2(g)的平衡常数(写出计算过程)
2SO2(g) + O2(g)的平衡常数(写出计算过程)
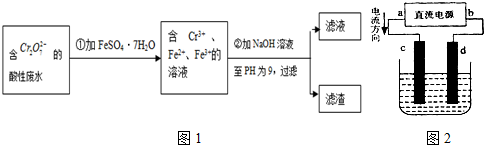
(Ⅱ)化学试剂的生产和电镀工业排放的废水中常含有20~100mg.L-1Cr(Ⅵ),饮用含Cr(Ⅵ)的水会损害人的肠胃等,已知Cr(Ⅲ)的毒性是Cr(Ⅵ)的0.5%,国家规定工业废水含Cr(Ⅵ)的量排放标准为0.1mg.L-1。工业上常用化学法和电解法处理含Cr(Ⅵ)废水,再将Cr(Ⅲ)转化成沉淀除去,某研究性学习小组为研究废水的净化,设计了如下实验流程:
(1)配平第①步反应的离子方程式:
(2)第②步中用PH试纸测定溶液PH的操作是:
(3)设计一个电解装置也可以实现上述目的,装置如下图(用铁棒和石墨作电极):
电极材料:c为:
电极反应:d极:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com