
钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法错误的是
| A.未知物质X为CO2,属于氧化产物 |
| B.每转移1mol e-时,生成2mol X |
| C.反应中PdCl2作氧化剂,被还原 |
| D.还原性:CO>Pd |
B
解析试题分析:CO为常见的还原剂,则钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,因此该反应中碳元素的化合价升高,Pd元素的化合价降低,结合质量守恒定律可知,发生反应的化学方程式为CO+PdCl2+H2O=CO2+Pd↓+2HC1。则A、由反应可知,X物质为CO2,属于氧化产物,故A正确;B、X物质为CO2,因此碳元素的化合价从+2价升高到+4价,失去2个电子,所以反应中转移的电子为1 mo1时,生成0.5molCO2,故B错误;C、反应中PdCl2作氧化剂,得电子而被还原,故C正确;D.氧化还原反应中还原剂的还原性强于还原产物的。反应中CO作还原剂,Pd为还原产物,因此还原性为:CO>Pd,故D正确,答案选B。
考点:考查氧化还原反应的有关判断和计算


科目:高中化学 来源: 题型:单选题
实验室可以用高锰酸钾与浓盐酸反应制取氯气,反应的化学方程式如下:
2KMn04+16HCl(浓) = 2KCl+5Cl2↑+2MnCl2+8H20
对于该反应,下列说法正确的是
| A.HCl是氧化剂 | B.是非氧化还原反应 |
| C.反应中锰元素被还原 | D.反应中氢元素的化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
置换反应的通式可以表示为:
单质(1)+化合物(1)= 单质(2)+化合物(2)
请联系所学过的单质 (如H2、C、Si、Cl2、Br2、I2、Na、Mg、Al、Cu、Fe等)的性质,写出满足以下条件的化学方程式(各写一个)。
(1)单质(1)和单质(2)都是金属: ;
(2)单质(1)是金属,而单质(2)是非金属: ;
(3)单质(1)是非金属,而单质(2)是金属: ;
(4)单质(1)和单质(2)都是非金属: 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质性质的比较,正确的是
| A.热稳定性:Na2CO3>NaHCO3>H2CO3 |
| B.熔点:K>Na>Li |
| C.同条件下,同浓度溶液的pH值:NaHCO3>Na2CO3 |
| D.还原性:S2->Br->I- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4==2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3==2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42->IO3->I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1∶5 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列陈述I、II正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | H2O2、SO2都能使酸性高锰酸钾褪色 | 前者表现出还原性后者表现出漂白性 |
| B | 纯银器表面在空气中渐渐变暗 | 发生了化学腐蚀 |
| C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | 说明Ksp(BaSO4)大于Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:还原性HSO—3>I—,氧化性IO—3>I2。在含0.3mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法不正确的是
| A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B.a点时消耗NaHSO3的物质的量为0.12mol |
| C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol |
| D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
除废气NO的反应原理为:2CO+2NO=N2+2CO2有关该反应的说法不正确的是 ( )
| A.反应中CO为氧化剂 |
| B.反应中NO被还原 |
| C.在反应生成1 mol N2时,转移的电子为4 mol |
| D.CO和NO都是无色有毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
镁是海水中含量较多的金属,镁、镁合金及其镁的化合物在科学研究和工业生产中用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g)=MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g)=Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) △H3
则△H3 = kJ·mol-1。
(2)工业上可用电解熔融的无水氯化镁获得镁。其中氯化镁脱水是关键工艺之一,一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4Cl·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ;电解熔融氯化镁,阴极的电极反应式为 。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:Mg(AlH4)2=MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为 。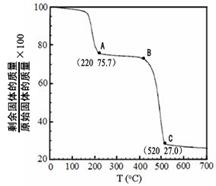
(4)工业上用MgC2O4·2H2O热分解制超细MgO,其热分解曲线如图。
图中隔绝空气条件下B→C发生反应的化学方程式为 。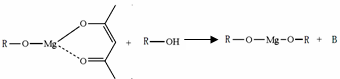
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为: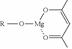 ,它可发生如下反应:
,它可发生如下反应:
ROH与B的核磁共振氢谱如下图: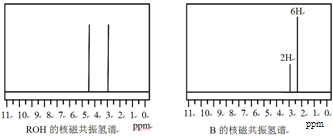
ROH由C、H、O、F四种元素组成的含氟有机物,分子中只有1个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为 ; B的结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com