
【题目】某主族元素R的最高正化合价与最低负化合价代数和为4,下列叙述不正确的是
A. R的气态氢化物为H2R B. R的最高价氧化物的水化物为H2RO4
C. R一定是第IVA族元素 D. R的最高价氧化物为RO3
科目:高中化学 来源: 题型:
【题目】
铁及其氧化物是日常生活生产中应用广泛的材料。请回答下列问题:
(l)基态铁原子的价电子轨道表达式为__________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+_______Fe2+(填“大于”或“小于”),原因是________________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为______(标出配位键),空间构型为_________,其中氮原子的杂化方式为_______;与ClO4-互为等电子体的分子或离子有__________(任写两种)。
(4)金属铁晶体原子采用________堆积.铁晶体的空间利用率为______(用含π的式子表示)。
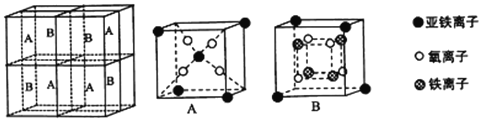
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该权化物中Fe2+、Fe3+、O2-的个数比为_______(填最简整数比);己知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则品胞参数a 为_______nm(用含d 和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。(1)已知:①C(s)+H2O(g)═CO(g)+H2(g) △H=+131.3kJ·mol-1
②CO2(g)+H2(g)═CO(g)+H2O(g) △H=+41.3kJ·mol-1
则碳与水蒸气反应生成二氧化碳和氢气的热化学方程式为____________。该反应在____________(填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①10~20min内,N2的平均反应速率v(N2)=____________。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_________填字母序号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
(3)研究表明:反应CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020mol·L-1,在该条件下达到平衡时,CO的转化率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示。下列说法正确的是( )
cC(g)。反应过程中,物质A的体积分数和C的体积分数随温度(T)的变化曲线如图所示。下列说法正确的是( )

A. 该反应的逆反应是放热反应
B. 该反应在T1、T3温度时达到化学平衡
C. 该反应在T2温度时达到化学平衡
D. 升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)是无色、有强还原性的液体,实验室制备水合肼的原理为:
CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl
据此,某学生设计了下列实验.
【制备NaClO溶液】实验装置如下图左图所示(部分夹持装置已省略)
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3

(1)配制30 %NaOH溶液时,所需玻璃仪器除量筒外还有__________(填字母)。
A.容量瓶 B.烧杯 C.移液管 D.玻璃棒
(2)装置I中发生的离子反应方程式是_______________;Ⅱ中玻璃管a的作用为____________;为了提高NaClO的产率,需对I中产生的Cl2进行净化,所用试剂是________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的___________________
【制取水合肼】实验装置如上图右图所示
(3)反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2 H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式____________________;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品,B装置的名称是______________
【测定肼的含量】
(4)称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol.L-1 的I2溶液滴定。
已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为____________;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对SO2和SO3的叙述正确的是 ( )
A. 通常条件下,SO2是无色、无味的气体,易溶于水
B. 都是酸性氧化物,其水溶液都是强酸
C. 都可使品红溶液褪色,加热时红色又能再现
D. 都能跟碱液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,需加氧化剂才能实现的是
A. Cl2 →NaClO B. H2O2 → O2 C. (NH4)2SO4 →N2 D. CaO→CaCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com