
【题目】水在25℃、100℃两种温度下的电离平衡曲线如下图所示,下列说法正确的是

A.图中四点Kw间的关系是:a=d<c<b
B.从a点到c点,可采用温度不变,在水中加入少量 Na2CO3固体的方法
C.从a点到d点,可采用温度不变,在水中加入少量 NaOH固体的方法
D.若处在b点所在温度,将pH=2的稀H2SO4 (该温度下H2SO4=2H++SO42-)与 pH= 10的NaOH溶液等积混合后,所得溶液呈中性
【答案】AD
【解析】
A.a、d都处于25℃时,Kw相等,然后比较b、c两点的c(H+)和c(OH-)的大小,依此比较Kw的大小;
B.从a点到c点c(H+)和c(OH-)的变化以及Kw只受温度影响来分析;
C.从a点到d点c(H+)变大,但c(OH-)变小,温度不变,Kw不变;
D.根据b点时Kw计算酸与碱溶液中c(H+)和 c(OH-),然后判断溶液的酸碱性。
A.a、d都处于25℃时,Kw相等,b点c(H+)和c(OH-)都大于c点的c(H+)和c(OH-),c点的c(H+)和c(OH-)大于a点c(H+)和c(OH-),c(H+)和c(OH-)越大,Kw越大,故a=d<c<b,故A正确;
B. 若从a点到c点,c(H+)变大,c(OH-)变大,Kw增大,温度应升高,但在25℃时在水中加入少量Na2CO3固体,c(H+)变小,c(OH-)变大,Kw不变,故B错误;
C.加碱,c(OH-)增大,c(H+)减小,故C错误;
D.b点所在的温度,Kw= c(H+)×c(OH-)=1012,若处在b点时,pH=2的硫酸中c(H+)=102mol/L,pH=10的NaOH中c(OH-)=![]() mol/L =102mol/L,二者等体积混合后,溶液显中性,故D正确;
mol/L =102mol/L,二者等体积混合后,溶液显中性,故D正确;
故答案为:AD。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】将amol NaHCO3和bmol Na2O2固体混合后,在密闭容器中加热到250℃,让其充分反应.当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,![]() 的值可能为
的值可能为
A.1.0B.1.35C.1.5D.2.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有SiO32—、OH—、CO32—、SO42—、AlO2—、HCO3—、Na+、Mg2+、Fe3+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
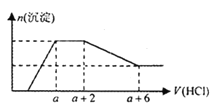
A.原溶液中一定含有Na2SO4
B.反应最后形成的溶液中的溶质只有NaCl
C.原溶液中含有CO32- 与AlO2- 的物质的量之比为1∶2
D.原溶液中一定含有的阴离子是:OH—、CO32—、SiO32—、AlO2—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将甲、乙两个装有不同物质的针筒用导管连接起来,将甲针筒内的物质压到乙针筒内,进行下列实验:

下列说法正确的是( )
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 乙针筒里的现象 |
A | H2S | CuSO4溶液 | 产生黑色沉淀 |
B | H2S | FeSO4溶液 | 产生黑色沉淀 |
C | SO2 | H2S | 出现淡黄色固体 |
D | SO2 | 紫色石蕊溶液 | 先变红后褪色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应对应的离子方程式正确的是( )
A.次氯酸钠溶液中通入过量二氧化硫ClO﹣+H2O+SO2→HClO+HSO3﹣
B.向碳酸氢钠溶液中加入过量氢氧化钙溶液2HCO3﹣+Ca2++2OH﹣→CaCO3↓+2H2O+CO32-
C.氢氧化钡溶液与硫酸溶液反应得到中性溶液Ba2++OH﹣+H++SO42﹣→BaSO4↓+H2O
D.50 mL 1mol/L的NaOH溶液中通入0.03mol H2S:5OH﹣+3H2S→HS﹣+2S2﹣+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃能在臭氧作用下发生键的断裂,形成含氧衍生物:

 +R3COOH
+R3COOH
根据产物的结构可以推测原烯烃的结构.
(1)现有一化学式为C10H18的烃A,经过臭氧作用后可以得到 CH3COOH和B(结构简式如图).

A的结构简式是________________________
(2)A经氢化后得到的烷烃的命名是___________.
(3)烃A的一种同类别同分异构体,经过臭氧作用后,所有产物都不具有酸性.该同分异构体的结构简式是__________.
(4)以B为原料通过三步反应可制得化学式为(C6H10O2)n的聚合物,其路线如下:

写出该聚合物的结构简式:________________.
在进行第二步反应时,易生成一种含八元环的副产物,其结构简式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时几种物质的溶解度见下表。室温下,向500g硝酸钾饱和溶液中投入2g食盐,下列推断正确的是( )
物质 | 溶解度( g/100g水) |
氯化钠 | 36 |
硝酸钾 | 32 |
硝酸钠 | 87 |
氯化钾 | 37 |
A.食盐不溶解
B.食盐溶解,无晶体析出
C.食盐溶解,析出2 g硝酸钾晶体
D.食盐溶解,析出2 g氯化钾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器中,可逆反应A(s)![]() B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g)-Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com