
【题目】烯烃能在臭氧作用下发生键的断裂,形成含氧衍生物:

 +R3COOH
+R3COOH
根据产物的结构可以推测原烯烃的结构.
(1)现有一化学式为C10H18的烃A,经过臭氧作用后可以得到 CH3COOH和B(结构简式如图).

A的结构简式是________________________
(2)A经氢化后得到的烷烃的命名是___________.
(3)烃A的一种同类别同分异构体,经过臭氧作用后,所有产物都不具有酸性.该同分异构体的结构简式是__________.
(4)以B为原料通过三步反应可制得化学式为(C6H10O2)n的聚合物,其路线如下:

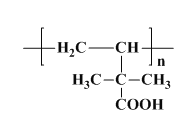
写出该聚合物的结构简式:________________.
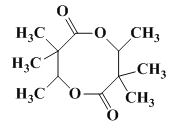
在进行第二步反应时,易生成一种含八元环的副产物,其结构简式为________.
【答案】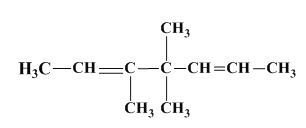 3,4,4﹣三甲基庚烷
3,4,4﹣三甲基庚烷 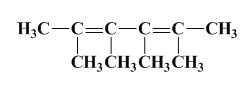
【解析】
(1)分析题目给出的信息,进行逆向推理即可;根据化学式为C10H18的烃A,则A烯烃应该是下列三个片断结合而成,2个![]() 和
和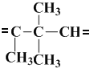 ,再结合反应原理解答该题;
,再结合反应原理解答该题;
(2)根据(1)的分析所得A的结构简式,再根据系统命名法命名与H2发生加成反应的产物;
(3)烃A的一种同类别同分异构体,经过臭氧作用后,所有产物都不具有酸性,说明双键碳原子上没有氢原子,据此分析;
(4)B为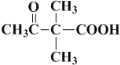 ,分子式为:C6H10O3,第一步发生生成C6H12O3,则羰基与氢气加成生成醇羟基即结构式为
,分子式为:C6H10O3,第一步发生生成C6H12O3,则羰基与氢气加成生成醇羟基即结构式为 ;第二步
;第二步 生成C6H10O2,则脱去1分子水,即醇羟基发生消去反应生成碳碳双键即结构式为
生成C6H10O2,则脱去1分子水,即醇羟基发生消去反应生成碳碳双键即结构式为 ;第三步
;第三步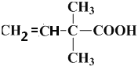 发生加聚反应生成
发生加聚反应生成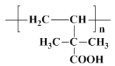 ,据此分析解答。
,据此分析解答。
(1)根据题目所给信息可知:碳碳双键在酸性高锰酸钾作用下,生成2个碳氧双键,现生成的2种化合物中共有3个碳氧双键,故A中含有2个碳碳双键,根据化学式为C10H18的烃A,则A烯烃应该是下列三个片断结合而成,2个![]() 和
和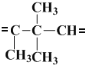 ,故A的结构简式是
,故A的结构简式是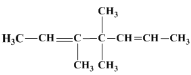 ;
;
(2)根据(1)的分析,A为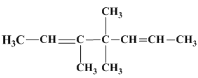 ,经氢化后双键都被加成为单键,所以得到的烷烃的命名是3,4,4﹣三甲基庚烷;
,经氢化后双键都被加成为单键,所以得到的烷烃的命名是3,4,4﹣三甲基庚烷;
(3)烃A的一种同类别同分异构体,经过臭氧作用后,所有产物都不具有酸性,说明双键碳原子上没有氢原子,则该同分异构体的结构简式是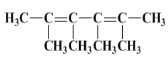 ;
;
(4)B为 ,分子式为:C6H10O3,第一步发生反应生成C6H12O3,则羰基与氢气加成生成醇羟基即结构式为
,分子式为:C6H10O3,第一步发生反应生成C6H12O3,则羰基与氢气加成生成醇羟基即结构式为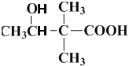 ;第二步
;第二步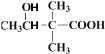 生成6H10O2,则脱去1分子水,即醇羟基发生消去反应生成碳碳双键即结构式为
生成6H10O2,则脱去1分子水,即醇羟基发生消去反应生成碳碳双键即结构式为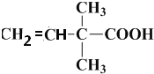 ;第三步
;第三步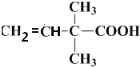 发生加聚反应生成
发生加聚反应生成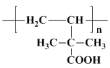 ;第二步
;第二步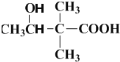 反应时,2分子
反应时,2分子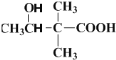 易生成一种含八元环的副产物,即羟基与羧基、羧基与羟基发生酯化反应生成八元环的酯类物质,所以其结构简式为
易生成一种含八元环的副产物,即羟基与羧基、羧基与羟基发生酯化反应生成八元环的酯类物质,所以其结构简式为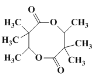 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间的转化均能实现的是
A.NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
B.CuCl2(aq)![]() Cu(OH)2(s)
Cu(OH)2(s) ![]() Cu(s)
Cu(s)
C.MgCl26H2O(s) ![]() MgCl2(s)
MgCl2(s)![]() Mg(s)
Mg(s)
D.NH3(g)![]() NO(g)
NO(g)![]() HNO3(aq)
HNO3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含锌矿渣中提取制备锌白(ZnO)有多种方法,其中氨一碳酸氢铵法的优点是成本低。请根据以下材料,回答问题:
材料1:某矿渣的主要成份为ZnO、Fe2O3、PbO、MnO、CuO、SiO2。
材料2:主要反应原理:ZnO+NH4HCO3+3NH3=Zn(NH3)4CO3 + H2O,类似的也可以生成[Cu(NH3)4] 2+、 [Pb(NH3)4]2+这样的络合离子,这些络合离子中的金属元素同样可以被置换出来,同时锰元素会随着金属锌一起进入浸出液中。
材料3:相关阳离子的氢氧化物的Ksp数据如表所示(室温):
阳离子 | Fe2+ | Mn2+ | Pb2+ | Fe3+ | Mn4+ | Pb4+ |
Ksp | 8.0×10-16 | 4.0×10-14 | 1.2×10-15 | 4.0×10-38 | 1.9×10-13 | 3.2×10-66 |
材料4:可选氧化剂与还原剂:
编号 | A | B | C | D |
氧化剂 | 氯气 | 35%过氧化氢 | 过氧化钠 | 酸性高锰酸钾溶液 |
还原剂 | 镁粉 | 铝粉 | 碳粉 | 锌粉 |
材料5:基本工艺(部分):
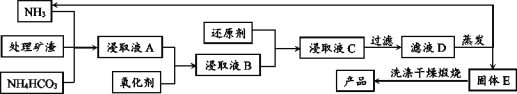
(1)加入氧化剂最好应选择材料4中的_______(填编号);后又加入还原剂的目的是还原溶液中的[Cu(NH3)4]2+、[Pb(NH3)4]2+等离子,请在材料4中选择合适的还原剂写出其中一个离子方程式_______.
(2)对滤液D的蒸发在工艺流程上也叫“蒸氨”,此过程中得到一种碱式盐沉淀物和两种气体,产生的气体可以在经过碱石灰处理后得到纯净而干燥的氨气。固体E经洗涤干燥后,灼烧得到产品,并产生水和CO2。则“蒸氨”过程中发生的化学反应方程式可表述为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g) +yB(g)![]() z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
A.x+y < zB.平衡向正反应方向移动
C.C的体积分数下降D.B的转化率升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水在25℃、100℃两种温度下的电离平衡曲线如下图所示,下列说法正确的是

A.图中四点Kw间的关系是:a=d<c<b
B.从a点到c点,可采用温度不变,在水中加入少量 Na2CO3固体的方法
C.从a点到d点,可采用温度不变,在水中加入少量 NaOH固体的方法
D.若处在b点所在温度,将pH=2的稀H2SO4 (该温度下H2SO4=2H++SO42-)与 pH= 10的NaOH溶液等积混合后,所得溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下:HCO3-+H2O![]() H2CO3+OH- Kh=2.2×10-8
H2CO3+OH- Kh=2.2×10-8
NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
将NH4HCO3溶液和氨水按一定比例混合,可用于浸取矿渣中ZnO。若溶液混合引起的体积变化可忽略。
(1) 0.2 mol·L-1氨水中,c(NH4+)、c(OH-)、c(NH3·H2O)、c(H+)按从大到小的顺序排列为________;常温下,0.2 mol·L-1NH4HCO3溶液 pH________7 (选填“>”、“〈”或“=”)。
(2) 0. 2 mol·L-1 氨水和 0. 2 mol·L-1 NH4HCO3 溶液等体积混合后(NH3 按 NH3·H2O算),c(NH4+)+c(NH3·H2O)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法,化合物![]() 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
C.苯和甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段 的高聚物,其单体是苯酚和甲醛
的高聚物,其单体是苯酚和甲醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:FeCl3(aq)+3KSCN(aq)![]() 3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
3KCl(aq)+Fe(SCN)3(aq),平衡时Fe(SCN)3的物质的量浓度与温度T的关系如图所示,则下列说法正确的是
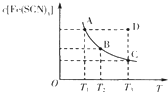
A.A点与B点相比,A点的c(Fe3+)大
B.加入KCl固体可以使溶液由D点变到C点
C.反应处于D点时,一定有υ(正)<υ(逆)
D.若T1、T2温度下的平衡常数分别为K1、K2,则K1<K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了验证反应物浓度对反应速率的影响,选用硫酸酸化的高锰酸钾溶液与草酸溶液在室温下进行反应。实验中所用的草酸为稀溶液,可视为强酸。
(1)将高锰酸钾氧化草酸的离子方程式补充完整。
2MnO4- +_______C2O42- +_____ _____=2Mn2+ +______CO2↑ +_______H2O
(2)该小组进行了实验I,数据如下。
H2SO4溶液 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.1mol/L | 2:03 |
1mL 2mol/L | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
一般来说,其他条件相同时,增大反应物浓度,反应速率______。但分析实验数据,得到的结论是______。
(3)该小组欲探究出现上述异常现象的原因,在实验I的基础上,只改变草酸溶液浓度进行了实验II,获得实验数据并绘制曲线图如下。
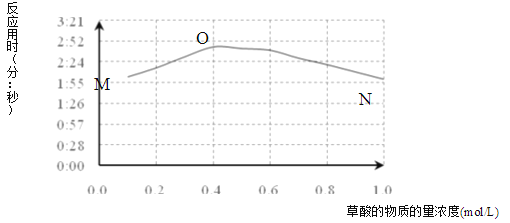
①用文字描述曲线图表达的信息______。
②该小组查阅资料获取如下信息,其中能够解释MO变化趋势的是______。
a | KMnO4与H2C2O4反应是分步进行的,反应过程中生成Mn(VI)、Mn(III)、Mn(IV),最终变为无色的Mn(II)。(括号中罗马数字表示锰的化合价) |
b | 草酸根易与不同价态锰离子形成较稳定的配位化合物。 |
c | 草酸稳定性较差,加热至185℃可分解。 |
(4)该小组为探究ON段曲线变化趋势的原因,又进行了实验III,所得数据如下。
H2SO4溶液 | Na2SO4固体 | KMnO4溶液 | H2C2O4溶液 | 褪色时间(分:秒) |
1mL 0.1mol/L | 1.9×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 16:20 |
1mL 0.5mol/L | 1.5×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 8:25 |
1mL 1.0mol/L | 1.0×10-3mol | 2mL 0.01mol/L | 1mL 0.2mol/L | 6:15 |
1mL 2.0mol/L | 0 | 2mL 0.01mol/L | 1mL 0.2mol/L | 2:16 |
该小组进行实验III的目的是______。
(5)综合实验I、II、III,推测造成曲线MN变化趋势的原因______。为验证该推测还需要补充实验,请对实验方案进行理论设计______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com