
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。(杂质发生的电极反应不必写出)请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①写出电解饱和NaCl溶液总的离子方程式 。
②在X极附近观察到的现象是_______________________。检验Y电极反应产物的方法是________________。
(2)如要用电解方法精炼粗铜(含有锌铁镍银金和铂等微量杂质),电解液a选用CuSO4溶液,则:
①X电极发生的反应类型为 ;②Y电极的材料是_____________,主要电极反应式为_______________。CuSO4溶液的浓度 (填 “不变”“略有增加”或“略有减少”)
【答案】(1)①2Cl-+2H2O![]() 2OH–+H2↑+Cl2↑(2分)②溶液变红,有气泡溢出。用淀粉KI试纸靠近Y电极,如果试纸变蓝,则说明产物是氯气。(4分)
2OH–+H2↑+Cl2↑(2分)②溶液变红,有气泡溢出。用淀粉KI试纸靠近Y电极,如果试纸变蓝,则说明产物是氯气。(4分)
(2)①还原反应;(1分)②粗铜,Cu-2e—=Cu2+。略有减少(3分)
【解析】(1)①电解饱和NaCl溶液生成氢气、氯气和氢氧化钠,总的离子方程式2Cl-+2H2O![]() 2 OH–+H2↑+Cl2↑;②X极是阴极,X电极反应式为
2 OH–+H2↑+Cl2↑;②X极是阴极,X电极反应式为![]() ,X附近观察到的现象是溶液变红,有气泡溢出,Y电极是阳极,电极反应为
,X附近观察到的现象是溶液变红,有气泡溢出,Y电极是阳极,电极反应为![]() ,反应产物是氯气,检验方法是用淀粉KI试纸靠近Y电极,如果试纸变蓝,则说明产物是氯气;(2)如要用电解方法精炼粗铜(含有锌铁镍银金和铂等微量杂质),电解液a选用CuSO4溶液,粗铜做阳极、精铜做阴极;①X电极为阴极,发生的反应为
,反应产物是氯气,检验方法是用淀粉KI试纸靠近Y电极,如果试纸变蓝,则说明产物是氯气;(2)如要用电解方法精炼粗铜(含有锌铁镍银金和铂等微量杂质),电解液a选用CuSO4溶液,粗铜做阳极、精铜做阴极;①X电极为阴极,发生的反应为![]() ,类型为还原反应;②Y电极是阳极,材料是粗铜,主要电极反应式为Cu-2e—=Cu2+。CuSO4溶液的浓度变小。
,类型为还原反应;②Y电极是阳极,材料是粗铜,主要电极反应式为Cu-2e—=Cu2+。CuSO4溶液的浓度变小。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:
【题目】[2017海南][双选]下列实验操作正确的是
A.滴定前用待测液润洗锥形瓶
B.容量瓶和滴定管使用前均需要检漏
C.蒸馏完毕时,先关闭冷凝水,再停止加热
D.分液时,下层溶液先从下口放出,上层溶液再从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 浓度均为0.1 molL﹣1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③<②<①
B. 工业上常用Na2SO3溶液作为吸收液脱除烟气中的SO2 ,随着SO2的吸收,吸收液的pH不断变化。当吸收液呈酸性时:c (Na+)=c (SO32﹣)+c (HSO3﹣)+c (H2SO3)
C. 常温下,将0.1 molL﹣1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CH3COO-)/c(CH3COOH)的值增大到原来的100倍
D. 向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/L NaOH溶液:c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列叙述中正确的是
A.纤维素在人体内可水解为葡萄糖,故可用作人体的营养物质
B.补钙剂中常含有维生素D,其作用是为了促进钙的吸收
C.天然存在的动植物油脂,大多属于单甘油酯
D.蛋白质的盐析属于化学变化,可用于分离、提纯蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se),是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1) Se原子的核外电子排布式为____________。
(2) 比较As的第一电离能比Se______(填“大”或“小”)。
(3) SeO42-中Se-O的键角比SeO3的键角____(填“大”或“小”)原因是______________
(4) H2SeO4比H2SeO3水溶液的酸性___________。
(5) 硒单质是红色或灰色粉末,带灰色金属光泽的准金属,灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。
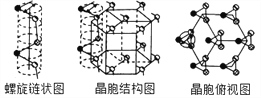
螺旋链中Se原子的杂化方式为__________。己知正六棱柱的边长为acm,高为b cm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的Se原子个数为_________,该晶体的密度为___________g/cm3 (用含NA、a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种短周期元素,X的气态氢化物化学式为H2X,此氢化物的相对分子质量与X最最高价氧化物的相对分子质量之比为17:40,X原子核内质子数与中子数相等,Y与X可以形成离子化合物Y2X,Y的阳离子电子层结构与Ne相同,Z与X同周期,其气态单质是双原子分子,两原子共用1对电子.试回答:
(1)写出各元素名称:X______、Y______、Z______.
(2)X离子的结构简式图为_________,X与Y形成的离子化合物的化学式为______,Z与氢形成的化合物的化学式 ______.
(3)Y单质在空气中燃烧产物与水反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填“>”、“<”或“=”)
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。
{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等温等压过程在低温下不能自发进行,而在高温下可自发进行的条件是
A. △H<0, △S<0 B. △H>0, △S<0 C. △H<0, △S>0 D. △H>0, △S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol,则H2SO4和Ca(OH)2反应的中和热
ΔH=2×(-57.3)kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com