
【题目】下列有关电解质溶液的说法正确的是( )
A. 浓度均为0.1 molL﹣1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③<②<①
B. 工业上常用Na2SO3溶液作为吸收液脱除烟气中的SO2 ,随着SO2的吸收,吸收液的pH不断变化。当吸收液呈酸性时:c (Na+)=c (SO32﹣)+c (HSO3﹣)+c (H2SO3)
C. 常温下,将0.1 molL﹣1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CH3COO-)/c(CH3COOH)的值增大到原来的100倍
D. 向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/L NaOH溶液:c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)
【答案】C
【解析】(NH4)2SO4中铵根水解生成氨和氢离子,(NH4)2CO3,发生双水解,铵根生成氢离子,碳酸根生成氢氧根,氢离子和氢氧根反应生成水,就促进了铵根水解,(NH4)2Fe(SO4)2中铵根水解,亚铁离子也水解都生出氢离子,抑制了铵根的水解,c(NH4+)的大小顺序为:①<②<③,故A错误;B、当吸收液呈酸性时可以是NaHSO3,溶液中存在物料守恒c(Na+)=c(H2SO3)+c(SO32-)+c(HSO3-),可以是NaHSO3和亚硫酸钠混合溶液可能呈酸性,物料守恒不是选项中的物料守恒,故B错误:C、加水稀释时促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)减小,温度不变,水的离子积常数不变,![]() ,
,![]() ,当溶液的pH从3.0升到5.0时,溶液中c(CH3COO-)/c(CH3COOH)的值增大到原来的100倍,C正确;D、向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液,所得溶液为Na2CO3与NaHCO3混合溶液,CO32-的水解程度大于HCO3- 的水解,H+与CO32-浓度会减小,OH-与HCO3-的浓度会增加,c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+),故D错误。故选C。
,当溶液的pH从3.0升到5.0时,溶液中c(CH3COO-)/c(CH3COOH)的值增大到原来的100倍,C正确;D、向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液,所得溶液为Na2CO3与NaHCO3混合溶液,CO32-的水解程度大于HCO3- 的水解,H+与CO32-浓度会减小,OH-与HCO3-的浓度会增加,c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H+),故D错误。故选C。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g) ![]() 2Z(g) 、②2M(g)
2Z(g) 、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
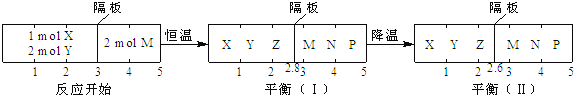
下列判断正确的是
A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(I)时,X的转化率为![]()
D.在平衡(I)和平衡(II)中M的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浓硫酸与木炭粉在加热条件下的化学方程式为_____________________。
(2)已知酸性KMnO4溶液可以吸收SO2,试用下图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是:
_____→_____→____→_____。(填装置的编号)

(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是_________,B瓶溶液的作用是_____________,C瓶溶液的作用是__________。
(4)装置②中所加的固体药品是_______________,可确证的产物是_______。
(5)装置③中所盛溶液是____________________,可验证的产物是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茅台酒中存在少量具有凤梨香味的物质X ,其结构如图所示,下列说法正确的是( )
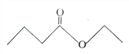
A. X难溶于乙醇
B. X的分子式为C6H10O2
C. 酒中的少量丁酸能抑制X的水解
D. 分子式为C4H8O2且官能团与X相同的物质共有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述中不正确的是
A.锌、铜电极和稀硫酸溶液构成的原电池中铜是正极
B.在镀件上镀铜时可用金属铜作阳极
C.用电解法精炼粗铜时粗铜发生氧化反应
D.用电解法精炼粗铜时纯铜作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活处处有化学。下列说法正确的是
A.制饭勺、饭盒、高压锅等的不锈钢是合金
B.做衣服的棉和麻均与淀粉互为同分异构体
C.煎炸食物的花生油和牛油都是高分子化合物
D.磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究NH3的溶解性,某兴趣小组按如图所示装置进行实验(f为止水夹),请回答下列问题:

(1)写出实验室制取氨气的化学方程式______________。
(2)要得到干燥的氨气可选用______________作干燥剂。
A.碱石灰(CaO和NaOH的混合物) B.浓硫酸
C.浓硝酸 D.氢氧化钠溶液
(3)用如图装置进行喷泉实验,仪器a是___________(仪器名称)。
(4)若烧杯c的水中滴有酚酞,实验结束后,a中溶液呈_______(填“红”或“蓝”)色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。(杂质发生的电极反应不必写出)请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①写出电解饱和NaCl溶液总的离子方程式 。
②在X极附近观察到的现象是_______________________。检验Y电极反应产物的方法是________________。
(2)如要用电解方法精炼粗铜(含有锌铁镍银金和铂等微量杂质),电解液a选用CuSO4溶液,则:
①X电极发生的反应类型为 ;②Y电极的材料是_____________,主要电极反应式为_______________。CuSO4溶液的浓度 (填 “不变”“略有增加”或“略有减少”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合溶液,加入反应容器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50~60 ℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸与浓硝酸的混合酸时,操作注意事项是将__________注入到________ 里,并______________(填操作名称)。
(2)步骤③中,发生的化学反应方程式是
________________________________________________________________________。
为了使反应在50~60 ℃下进行,常用的方法是________________________________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是__________。
(4)步骤④中粗产品用5% NaOH溶液洗涤的目的是____________。
(5)硝基苯是_______颜色________(填”固体,液体,气体”之一),_______(填”有,无”之一)毒,_____(填”可,难”之一)溶于水。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com