
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合溶液,加入反应容器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50~60 ℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸与浓硝酸的混合酸时,操作注意事项是将__________注入到________ 里,并______________(填操作名称)。
(2)步骤③中,发生的化学反应方程式是
________________________________________________________________________。
为了使反应在50~60 ℃下进行,常用的方法是________________________________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是__________。
(4)步骤④中粗产品用5% NaOH溶液洗涤的目的是____________。
(5)硝基苯是_______颜色________(填”固体,液体,气体”之一),_______(填”有,无”之一)毒,_____(填”可,难”之一)溶于水。
【答案】 浓硝酸 浓硫酸 搅拌 ![]() 将反应容器放入50~60 ℃的水浴中加热 分液漏斗 除去残留的酸 无 液体 有 难
将反应容器放入50~60 ℃的水浴中加热 分液漏斗 除去残留的酸 无 液体 有 难
【解析】(1)由于浓硫酸溶于水放热,且浓硫酸的密度大于水的,操作注意事项是把浓硫酸沿着器壁慢慢的注入到盛有浓HNO3的烧杯中,同时用玻璃棒搅拌;(2)苯与浓硫酸、浓硝酸的混合物加热发生取代反应生成硝基苯的化学方程式为;![]() 。在步骤③中,为了便于控制反应在50摄氏度到60摄氏度下进行,常用的方法热水浴加热;(3)硝基苯不溶于水,分液即可分离粗硝基苯,所用到的仪器是分液漏斗;(4)由于生成的硝基苯中含有酸性物质硝酸、硫酸,所以粗产品用5%的NaOH 溶液洗涤的目的是除H2SO4、HNO3等物质;(5)纯硝基苯是无色、密度比水大,具有苦杏仁味的油状液体,有毒,难溶于水。
。在步骤③中,为了便于控制反应在50摄氏度到60摄氏度下进行,常用的方法热水浴加热;(3)硝基苯不溶于水,分液即可分离粗硝基苯,所用到的仪器是分液漏斗;(4)由于生成的硝基苯中含有酸性物质硝酸、硫酸,所以粗产品用5%的NaOH 溶液洗涤的目的是除H2SO4、HNO3等物质;(5)纯硝基苯是无色、密度比水大,具有苦杏仁味的油状液体,有毒,难溶于水。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 浓度均为0.1 molL﹣1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为:③<②<①
B. 工业上常用Na2SO3溶液作为吸收液脱除烟气中的SO2 ,随着SO2的吸收,吸收液的pH不断变化。当吸收液呈酸性时:c (Na+)=c (SO32﹣)+c (HSO3﹣)+c (H2SO3)
C. 常温下,将0.1 molL﹣1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CH3COO-)/c(CH3COOH)的值增大到原来的100倍
D. 向0.2 mol/LNaHCO3溶液中加入等体积0.1 mol/L NaOH溶液:c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________。
(3)0.1mol/L的NaHA溶液,测得溶液显碱性。则
① 该溶液中 c(H2A)_______________c(A2-)(填“>”、“<”或“=”)
② 作出上述判断的依据是_____________(用文字解释)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3 mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
绿矾为FeSO4 7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为___________。
常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的 pH=___________。
{Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等温等压过程在低温下不能自发进行,而在高温下可自发进行的条件是
A. △H<0, △S<0 B. △H>0, △S<0 C. △H<0, △S>0 D. △H>0, △S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上。已知汽车尾气中的主要污染物为NOx、CO、超细颗粒(PM2.5)等有害物质。目前,已研究出了多种消除汽车尾气污染的方法。根据下列示意图回答有关问题:
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
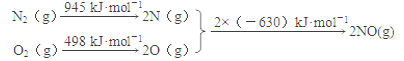
写出该反应的热化学方程式:_________________
(2)空燃比较易产生CO,有人提出可以设计反应2CO(g)===2C(s)+O2(g)来消除CO的污染。判断该设想是否可行,并说出理由:_____________________。
(3)在汽车上安装三元催化转化器可实现反应:
(Ⅱ)2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH <0 。若该反应在恒压的密闭容器中进行,则下列有关说法正确的是_______________
N2(g)+2CO2(g) ΔH <0 。若该反应在恒压的密闭容器中进行,则下列有关说法正确的是_______________
A.其他条件不变,增大催化剂与反应物的接触面积,能提高反应速率,使平衡常数增大
B.平衡时,其他条件不变,升高温度,逆反应速率增大,正反应速率减小
C.在恒温条件下,混合气体的密度不变时,反应达到化学平衡状态
D.平衡时,其他条件不变,增大NO的浓度,反应物的转化率都增大
(4)将NO和CO以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。以下说法正确的是__________。
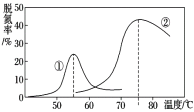
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.在该题条件下,两种催化剂分别适宜于55 ℃和75 ℃左右脱氮甲醇﹣空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图甲,
该燃料电池的电池反应式为 2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)
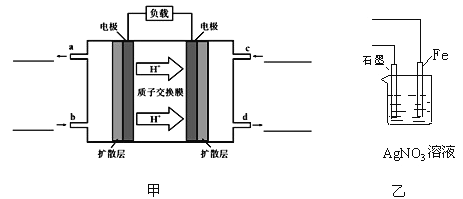
①负极的电极反应式为_______________,氧气从_______________(填b或c)口通入
②用该原电池电解AgNO3溶液,若Fe电极增重5.4g,则燃料电池在理论上消耗的氧气的体积为________mL(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。据图回答下列问题:
(1)写出A、C、D的结构简式:
A__________,C____________,D____________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________(反应类型________)。
②________________________(反应类型________)。
(3)⑤反应发生时对氯气要求:_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,某硫化锌精矿的主要成分是ZnS (还含有少量FeS等其它成分),以其为原料冶炼锌的工艺流程如图所示:
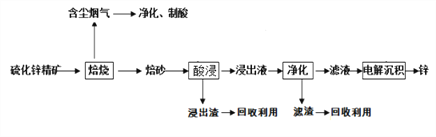
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
浸出液净化过程中加入的主要物质是锌粉,其作用是___________________。
(2)电解沉积过程中的阴极采用铝板,阳极采用情性电极,阳极的电极反应式是______________。
(3)在该流程中可循环使用的物质是Zn和_________。
(4)改逬的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,“氧压酸浸”中发生主要反应的离子方程式为_________________。
(5)硫化锌精矿(ZnS )遇到硫酸铜溶液可慢慢的转化为铜蓝(CuS)。请解释该反应发生的原理______________________________________________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一尼罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火锻红,….,冷淀,毀罐取出,…即倭铅也。”该炼锌工艺主要反应的化学方程式为__________________________(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol,则H2SO4和Ca(OH)2反应的中和热
ΔH=2×(-57.3)kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g) ![]() 2NO2(g) △H=-113.0 kJ mol-1
2NO2(g) △H=-113.0 kJ mol-1
2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196. 6 kJ mol-1
2SO3(g) △H=-196. 6 kJ mol-1
则NO2(g)+SO2(g) ![]() SO3(g)+N0(g) △H= ________.
SO3(g)+N0(g) △H= ________.
(2)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收N02时,发生的反应为:
2NO2+2OH- =NO2- +NO3- +H2O,反应中形成的化学键是________(填化学键的类型);用NaOH溶液吸收少量SO2的离子方程式为____________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。 部分实验结果如图所示:
①当容器内_______(填标号)不再随时间的变化而改变时,可以不断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。

③若A点对应实验中,S02(g)的起始浓度为c0 molL-1 ,经过t min达到平衡状态,该时段化学反应速率![]() (N02)= _________molL-1min -1.
(N02)= _________molL-1min -1.
④图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断::Tc_____Td(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com