
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g) ![]() 2NO2(g) △H=-113.0 kJ mol-1
2NO2(g) △H=-113.0 kJ mol-1
2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196. 6 kJ mol-1
2SO3(g) △H=-196. 6 kJ mol-1
则NO2(g)+SO2(g) ![]() SO3(g)+N0(g) △H= ________.
SO3(g)+N0(g) △H= ________.
(2)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收N02时,发生的反应为:
2NO2+2OH- =NO2- +NO3- +H2O,反应中形成的化学键是________(填化学键的类型);用NaOH溶液吸收少量SO2的离子方程式为____________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。 部分实验结果如图所示:
①当容器内_______(填标号)不再随时间的变化而改变时,可以不断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。

③若A点对应实验中,S02(g)的起始浓度为c0 molL-1 ,经过t min达到平衡状态,该时段化学反应速率![]() (N02)= _________molL-1min -1.
(N02)= _________molL-1min -1.
④图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断::Tc_____Td(填“>”、“=”或“<”)。
【答案】 -41.8kJ/mol 共价键 SO2+2OH-=SO32-+H2O d 降低温度 c0/5t =
【解析】(1)由①2NO(g)+O2(g)![]() 2NO2(g)△H=-113.0kJmol-1,②2SO2(g)+O2(g)
2NO2(g)△H=-113.0kJmol-1,②2SO2(g)+O2(g)![]() 2SO3(g)△H=-196.6kJmol-1,根据盖斯定律可知,
2SO3(g)△H=-196.6kJmol-1,根据盖斯定律可知, ![]() 可得NO2(g)+SO2(g)═SO3(g)+NO(g),则△H=
可得NO2(g)+SO2(g)═SO3(g)+NO(g),则△H=![]() =-41.8kJmol-1,即NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJmol-1;
=-41.8kJmol-1,即NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJmol-1;
(2)在离子反应2NO2+2OH- =NO2- +NO3- +H2O中NO2分子内的化学键存在键的断裂和形成,生成NO3- 时形成了共价键;用NaOH溶液吸收少量SO2生成Na2SO3的离子方程式为SO2+2OH-=SO32-+H2O;
(3)①a.反应前后气体的总物质的量不变,体积不变,则气体的压强始终不变,无法判断是平衡状态,故a错误;b.气体的总质量和气体总物质的量始终不变,气体的平均摩尔质量始终是定值,无法判断是平衡状态,故b错误;c.气体的总质量和气体的体积始终不变,则气体的密度始终不变,无法判断是平衡状态,故c错误;d.NO2的体积分数不再随时间变化而变化,为平衡状态,故d正确;答案为d;
②在原料气配比不变的情况下,欲将图中C点的平衡状态改变为B点的平衡状态,NO2的转化率增大,说明平衡正向移动,可采取降温的措施来实施;
③ NO2+SO2![]() SO3+NO
SO3+NO
起始浓度(molL-1) 0.4c0 c0 0 0
变化浓度为 (molL-1) 0.4c0 ×0.5
经过t min达到平衡状态,该时段化学反应速率![]() (NO2)=
(NO2)= ![]() molL-1min -1=c0/5tmolL-1min -1;
molL-1min -1=c0/5tmolL-1min -1;
③Tc点 NO2+SO2![]() SO3+NO
SO3+NO
起始物质的量(mol) n n 0 0
变化物质的量 (mol) 0.5n 0.5n 0.5n 0.5n
平衡物质的量 (mol) 0.5n 0.5n 0.5n 0.5n
此时平衡常数Kc=![]() =1;
=1;
Tc点 NO2+SO2![]() SO3+NO
SO3+NO
起始物质的量(mol) 3 n 2 n 0 0
变化物质的量 (mol) 1.2n 1.2n 1.2n 1.2n
平衡物质的量 (mol) 1.8n 0.8n 1.2n 1.2n
此时平衡常数Kd=![]() =1=Kc,因平衡常数只与温度有关,则Tc=Td。
=1=Kc,因平衡常数只与温度有关,则Tc=Td。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合溶液,加入反应容器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50~60 ℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸与浓硝酸的混合酸时,操作注意事项是将__________注入到________ 里,并______________(填操作名称)。
(2)步骤③中,发生的化学反应方程式是
________________________________________________________________________。
为了使反应在50~60 ℃下进行,常用的方法是________________________________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是__________。
(4)步骤④中粗产品用5% NaOH溶液洗涤的目的是____________。
(5)硝基苯是_______颜色________(填”固体,液体,气体”之一),_______(填”有,无”之一)毒,_____(填”可,难”之一)溶于水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g) + H2O(g)![]() CO2 (g)+ H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
CO2 (g)+ H2(g) 反应过程中不同条件下达到平衡时测定的部分数据见下表(表中t1>t2):
反应时间/min | n(CO)/mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说不正确的是( )
A. 反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D. 温度升至800℃,上述反应平衡常数变为1.64,则正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016江苏]大气中CO2含量的增加会加剧“温室效应”。下列活动会导致大气中CO2含量增加的是
A.燃烧煤炭供热 B.利用风力发电
C.增加植被面积 D.节约用水用电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() Lv的叙述错误的是
Lv的叙述错误的是
A. 原子序数116 B. 中子数177 C. 核外电子数116 D. 相对原子质量293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的烃分子
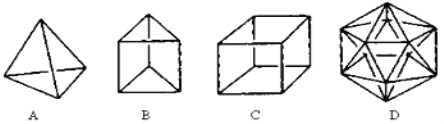
(1)结构D显然是不可能合成的,原因是 。
(2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷。则金刚烷的分子式为 。
(3)A的一种链状烃类同分异构体可由两分子乙炔聚合得到,则该链状烃的结构简式为 。
(4)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的碳碳键不是单双键交替排列的事实是 。
a.它的对位二元取代物只有一种
b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等
d.能发生取代反应和加成反应
(5)C在一定条件下可发生卤代反应,则C的六氯代物共有 种同分异构体。
(6)C的一种属于芳香烃的同分异构体是生产某种塑料的单体,则该芳香烃分子发生加聚反应的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链烃A是重要的有机化工原料,由A经以下反应可制备一种有机玻璃:
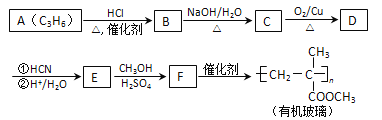
已知以下信息:
①核磁共振氢谱表明D只有一种化学环境的氢;
②羰基化合物可发生以下反应: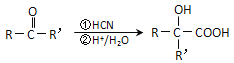 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子)
③E在甲醇、硫酸的作用下,发生酯化、脱水反应生成F。
回答下列问题:
(1)A的结构简式为_____,A生成B的反应类型为_______。
(2)B生成C的化学方程式为_______。
(3)D的结构简式为_____,分子中最多有 __________个原子共平面。
(4)F的化学名称为_______。
(5)F的同分异构体中能同时满足下列条件的共有 ______种(不含立体异构);其中核磁共振氢谱显示为4组峰,且峰面积比为3 : 2 : 2 : 1的是_____; (写出其中一种的结构简式)。
①能与饱和NaHCO3溶液反应产生气体 ②能使Br2的四氯化碳溶液褪色
(6)聚乳酸(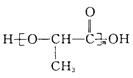 )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 ___________ 。合成路线流程图图示例如下:
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线 ___________ 。合成路线流程图图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池体积小、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某甲醇燃料电池的总反应式2CH4O + 3O2= 2CO2+ 4H2O,下图是该燃料电池的示意图。下列说法正确的是

A. a是甲醇燃料、b是氧气
B. 当转移6mole-时,消耗33.6LO2
C. 负极反应:CH4O - 6e-+ H2O = CO2↑+ 6H+
D. 质子从N电极区穿过交换膜移向M电极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是( )

A. 电池的负极反应为BH4--8e-+8OH-=BO2-+6H2O
B. 电池放电时Na+从b极区移向a极区
C. 电子从电极a经外电路流向电极b
D. 放电一段时间后,正负两极生成的OH-和消耗的OH-的量相等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com