
����Ŀ����������ϳɾ������½ṹ��������
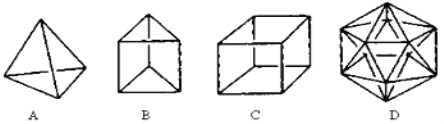
��1���ṹD��Ȼ�Dz����ܺϳɵģ�ԭ���� ��
��2���ڽṹA��ÿ����̼ԭ��֮�����һ��CH2ԭ���ţ������γɽ���顣������ķ���ʽΪ ��
��3��A��һ����״����ͬ���칹�������������Ȳ�ۺϵõ��������״���Ľṹ��ʽΪ ��
��4��B��һ��ͬ���칹������ķ���������֤���÷������е�̼̼�����ǵ�˫���������е���ʵ�� ��
a�����Ķ�λ��Ԫȡ����ֻ��һ��
b��������λ��Ԫȡ����ֻ��һ��
c������������̼̼���ļ��������
d���ܷ���ȡ����Ӧ�ͼӳɷ�Ӧ
��5��C��һ�������¿ɷ���±����Ӧ����C�����ȴ��ﹲ�� ��ͬ���칹�塣
��6��C��һ�����ڷ�������ͬ���칹��������ij�����ϵĵ��壬��÷��������ӷ����Ӿ۷�Ӧ�Ļ�ѧ����ʽΪ�� ��
���𰸡���1��̼ԭ�Ӳ����γ�5�����ۼ� ��2�֣���2��C10H16��2�֣�
��3��CH2= CH��C��CH��2�֣�
��4��b c��5��3 ��2�֣�
��6��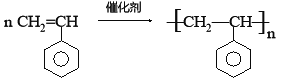
��������
�����������1��̼ԭ�������ֻ��4�����ӣ��ﵽ8�����ȶ��ṹʱ�����γ�4�����ۼ��������γ�5�����ۼ���
��2�����ݽṹ��֪���ɲ���6��CH2ԭ���ţ���CӦΪ10����HӦΪ6��2+4=16�����Է���ʽΪC10H16��
��3��A��һ����״����ͬ���칹�������������Ȳ�ۺϵõ����������Ȳ�Ľṹ��ʽ��֪����״���Ľṹ��ʽΪCH2= CH��C��CH��
��4����ķ�����ӦΪ������ѧ�����ǵ�˫�����棬����������̼̼���ļ�������ȣ�������λ��Ԫȡ����ֻ��һ�֣���֤���ýṹ�������������Ƿ�˫�����棬���Ķ�λ��Ԫȡ���ﶼֻ��һ�֣�����һ�������¶��ܷ���ȡ����Ӧ�ͼӳɷ�Ӧ������֤����Ϊbc��
��5��C�����ȴ��������ȴ����ͬ���칹��������ͬ�����ȴ��������֣��������ڡ���Խ��ߺ���Խ��ߣ�����ͬ���칹�塣
��6��C��һ�����ڷ�������ͬ���칹��������ij���ϵĵ��壬ӦΪ����ϩ�������Ӿ۷�Ӧ�����۱���ϩ������ʽΪ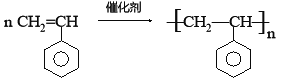 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��A���л���ѧ��ҵ�Ļ���ԭ�ϣ������������������һ�����ҵ�ʯ�ͻ�����չˮƽ��A����һ��ֲ���������ڼ���A�ɷ�����ͼ��ʾ��һϵ�л�ѧ��Ӧ����ͼ�ش��������⣺
(1)д��A��C��D�Ľṹ��ʽ��
A__________��C____________��D____________��
(2)д���٢�������Ӧ�Ļ�ѧ����ʽ����ע����Ӧ���ͣ�
��________________________(��Ӧ����________)��
��________________________(��Ӧ����________)��
(3)�ݷ�Ӧ����ʱ������Ҫ��_______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ƿ�����Ԫ����������������к�������뱵�ԭ��������86�����ԭ��������222����ѧ�һ�����ijЩ�����Կ���ֽ�ų����������������������Ϊ86��������Ϊ219��ԭ����ɡ����й���뱵�˵����ȷ����( )
A. ����ڱ�״���µ��ܶ� 9.91 g��L��1
B. ����Ļ�ѧ���ʽϻ�������˶������к�
C. �ԭ�Ӻ�����7�����Ӳ����������8������
D. �����������뱵�ͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2 mol������ȫȼ������ˮ����ʱ�ų�����484 kJ����������1 mol O===O����ȫ����ʱ��������496 kJ��ˮ������1 mol H��O���γ�ʱ�ų�����463 kJ����������1 mol H��H������ʱ��������Ϊ
A��920 kJ B��557 kJ C��436 kJ D��188 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO2��SO2�ܷ�����Ӧ:NO2+SO2![]() SO3+NO,ij�о�С��Դ˽������ʵ��̽����
SO3+NO,ij�о�С��Դ˽������ʵ��̽����
(1)��֪��2NO(g)+O2(g) ![]() 2NO2(g) ��H=-113.0 kJ mol-1
2NO2(g) ��H=-113.0 kJ mol-1
2SO2(g)+O2(g) ![]() 2SO3(g) ��H=-196. 6 kJ mol-1
2SO3(g) ��H=-196. 6 kJ mol-1
��NO2(g)+SO2(g) ![]() SO3(g)+N0(g) ��H= ________.
SO3(g)+N0(g) ��H= ________.
(2)ʵ���У�β�������ü���Һ���ա�NaOH��Һ����N02ʱ�������ķ�ӦΪ��
2NO2+2OH- =NO2- +NO3- +H2O,��Ӧ���γɵĻ�ѧ����________(�ѧ�������ͣ�����NaOH��Һ��������SO2�����ӷ���ʽΪ____________��
(3)�ڹ̶�������ܱ������У�ʹ��ij�ִ������ı�ԭ�������[n0(NO2) : n0 (SO2)] ���ж���ʵ��(����ʵ����¶ȿ�����ͬ��Ҳ���ܲ�ͬ�����ⶨNO2��ƽ��ת����[a(NO2)]�� ����ʵ������ͼ��ʾ:
����������_______(����)������ʱ��ı仯���ı�ʱ�����Բ��Ϸ�Ӧ�ﵽ�˻�ѧƽ��״̬��
a.�����ѹǿ
b.�����ƽ��Ħ������
c.������ܶ�
d.NO2���������
�����Ҫ��ͼ��C���ƽ��״̬�ı�ΪB���ƽ��״̬��Ӧ��ȡ�Ĵ�ʩ��________��

����A���Ӧʵ���У�S02(g)����ʼŨ��Ϊc0 molL-1 ������t min�ﵽƽ��״̬����ʱ�λ�ѧ��Ӧ����![]() (N02)= _________molL-1min -1.
(N02)= _________molL-1min -1.
��ͼ��C��D�����Ӧ��ʵ���¶ȷֱ�ΪTc��Td��ͨ�������жϣ���Tc_____Td(������������=��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĹ̶��ݻ����ܱ������У�������Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H��0����˵���÷�Ӧ�Ѵ�ƽ��״̬���ǣ� ��
CH3OH(g)+H2O(g) ��H��0����˵���÷�Ӧ�Ѵ�ƽ��״̬���ǣ� ��
A��CO2����������ڻ�������б��ֲ���
B�����������ܶȲ���ʱ��ı仯���仯
C����λʱ����ÿ����1.2mol H2��ͬʱ����0.4mol H2O
D����Ӧ��H2O��CH3OH�����ʵ���Ũ��֮��Ϊ1:1���ұ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˺������û�ѧ�ܣ�ȷ����ȫ���������������Ҫ��ֿ��ǻ�ѧ��Ӧ�ķ�Ӧ�ȣ�����ȡ��Ӧ��ʩ����ѧ��Ӧ�ķ�Ӧ��ͨ����ʵ����вⶨ��Ҳ�ɽ����������㡣
��1��ʵ���ã�5g�״���CH3OH��Һ���������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�113.5kJ�����������ʾ�״���ȼ���ȵ��Ȼ�ѧ����ʽΪ�� ��
��2���������������Ȼ�ѧ����ʽ����a b����������������������������
H2(g)+ 1/2O2(g)��H2O(g) ��H1��a kJ��mol-1
H2(g)+ 1/2O2(g)��H2O(l) ��H2��b kJ��mol-1
��3����1mol��̬������ij�ֹ��ۼ���Ҫ���յ������м��ܡ��ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ƿ�Ӧ��Ļ�ѧ�����ƻ���������Ļ�ѧ�����γɹ��̡��ڻ�ѧ��Ӧ�����У���ѧ����Ҫ�����������γɻ�ѧ���ֻ��ͷ�������
��ѧ�� | H��H | N��H | N��N |
����/kJ��mol��1 | 436 | 391 | 945 |
��֪��ӦN2(g)��3H2(g)![]() 2NH3(g) ��H��a kJ��mol��1���Ը��ݱ������м������ݹ���a��ֵ��_______________(ע����+����������)��
2NH3(g) ��H��a kJ��mol��1���Ը��ݱ������м������ݹ���a��ֵ��_______________(ע����+����������)��
��4�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ�ķ�Ӧ�Ƚ������㡣����ˮú���ϳɶ����ѵ�������Ӧ���£�
�� 2H2(g) + CO(g)![]() CH3OH(g)����H ����90.8 kJ��mol��1
CH3OH(g)����H ����90.8 kJ��mol��1
�� 2CH3OH(g)![]() CH3OCH3(g) + H2O(g)����H����23.5 kJ��mol��1
CH3OCH3(g) + H2O(g)����H����23.5 kJ��mol��1
�� CO(g) + H2O(g)![]() CO2(g) + H2(g)����H����41.3 kJ��mol��1
CO2(g) + H2(g)����H����41.3 kJ��mol��1
�ܷ�Ӧ��3H2(g) + 3CO(g)![]() CH3OCH3(g) + CO2(g)����H�� ��
CH3OCH3(g) + CO2(g)����H�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ�����Ʒ��Ŀǰ��Ҫ���á��Ӵ������������������ж��ڷ�Ӧ 2SO2+O2 ![]() 2SO3��˵������ȷ����( )
2SO3��˵������ȷ����( )
A. ֻҪѡ�����˵�������SO2��O2����ȫ��ת��ΪSO3
B. �ڹ�ҵ�ϳ�SO3ʱ��Ҫͬʱ���Ƿ�Ӧ���ʺͷ�Ӧ�ܴﵽ���������������
C. �÷�Ӧ�ﵽƽ���Ӧ����ȫֹͣ�ˣ������淴Ӧ���ʾ�Ϊ��
D. �ڴﵽƽ�����ϵ�У�������18Oԭ����ɵ�O2��18O��������SO2��SO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�����������˵����ȷ���ǣ� ��
A.2.24LCO��N2�����ĵ�����Ϊ1.4NA
B.��״���£�22.4��H2O������������С��NA
C.���³�ѹ�£�33.6L������56 g����ַ�Ӧ��ת�Ƶĵ�����Ϊ3NA
D.���³�ѹ�£�1.8 g H2O���е�������ΪNA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com