
【题目】一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是( )

A. 电池的负极反应为BH4--8e-+8OH-=BO2-+6H2O
B. 电池放电时Na+从b极区移向a极区
C. 电子从电极a经外电路流向电极b
D. 放电一段时间后,正负两极生成的OH-和消耗的OH-的量相等。
【答案】B
【解析】试题分析:由原电池工作原理示意图可知反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2得电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-。
反应中BH4-被氧化为BO2-,应为原电池的负极反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故A正确;该装置是原电池,原电池放电时,阳离子向正极移动,所以Na+从a极区移向b极区,故B错误;
a为负极,b为正极,电子从电极a经外电路流向电极b,故c正确;
根据电子守恒,放电一段时间后,正负两极生成的OH-和消耗的OH-的量相等,故D正确。


科目:高中化学 来源: 题型:
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g) ![]() 2NO2(g) △H=-113.0 kJ mol-1
2NO2(g) △H=-113.0 kJ mol-1
2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196. 6 kJ mol-1
2SO3(g) △H=-196. 6 kJ mol-1
则NO2(g)+SO2(g) ![]() SO3(g)+N0(g) △H= ________.
SO3(g)+N0(g) △H= ________.
(2)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收N02时,发生的反应为:
2NO2+2OH- =NO2- +NO3- +H2O,反应中形成的化学键是________(填化学键的类型);用NaOH溶液吸收少量SO2的离子方程式为____________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。 部分实验结果如图所示:
①当容器内_______(填标号)不再随时间的变化而改变时,可以不断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。

③若A点对应实验中,S02(g)的起始浓度为c0 molL-1 ,经过t min达到平衡状态,该时段化学反应速率![]() (N02)= _________molL-1min -1.
(N02)= _________molL-1min -1.
④图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断::Tc_____Td(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1molNa2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是
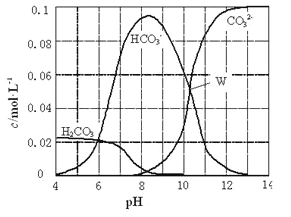
A. W点所示的溶液中:c (Na+)+c (H+)=2c(CO32-)+c (OH-)+c (Cl-)
B. pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3-)= c (OH-)+c (Cl-)
C. pH= 4的溶液中:c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol·L-1
D. pH=11的溶液中:c (Na+)>c (Cl-)>c (CO32-)>c (HCO3-)>c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
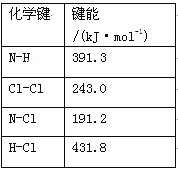
(1)①氯胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1 L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
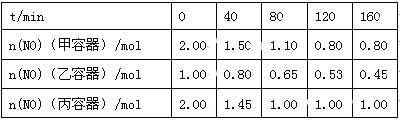
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
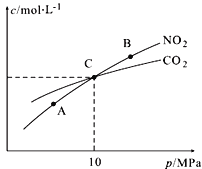
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
A. 1:2 B. 1:4 C. 3:4 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是( )
A.2.24LCO或N2所含的电子数为1.4NA
B.标准状况下,22.4升H2O中所含分子数小于NA
C.常温常压下,33.6L氯气与56 g铁充分反应,转移的电子数为3NA
D.常温常压下,1.8 g H2O含有的质子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被还原和被氧化的氮元素的质量比是( )
A. 3:2 B. 2:1 C. 1:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成生物体化学元素的论述,正确的是
A. 组成生物体的化学元素中,碳元素含量最多
B. 动物和植物所含的化学元素的种类差异很大
C. 无机自然界中的元素都可以参与组成生物体
D. 微量元素是维持正常生命活动不可缺少的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014·四川理综,6,6分)下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1 mol·L-1 NaHCO3溶液与0.1 mol·L -1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)
)>c(OH-)
B.20 mL 0.1 mol·L-1 CH3COONa溶液与10 mL 0.1 mol·L-1 HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH![]() )+c(OH-)
)+c(OH-)
D.0.1 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com