
【题目】(2014·四川理综,6,6分)下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1 mol·L-1 NaHCO3溶液与0.1 mol·L -1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)
)>c(OH-)
B.20 mL 0.1 mol·L-1 CH3COONa溶液与10 mL 0.1 mol·L-1 HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH![]() )+c(OH-)
)+c(OH-)
D.0.1 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
【答案】B
【解析】A、0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,二者恰好反应生成碳酸钠和水,碳酸根离子水解,溶液显碱性,且碳酸根的水解以第一步水解为主,因此所得溶液中:c(Na+)>c(CO32-)>c(OH-) >c(HCO3-),A不正确;B、20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后反应生成醋酸和氯化钠,反应中醋酸钠过量,所得溶液是醋酸钠、氯化钠和醋酸的混合液,且三种的浓度相等,呈酸性,说明醋酸的电离程度大于醋酸根的水解程度,因此所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),B正确;C、氨水是弱碱,盐酸是强碱,因此室温下,pH=2的盐酸与pH=12的氨水等体积混合后生成氯化铵和水,反应中氨水过量,溶液显碱性,因此所得溶液中:c(NH4+)>c(Cl-)>c(OH-) >c(H+),C不正确;D、0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,二者恰好反应生成醋酸钠和水,醋酸根水解,溶液显碱性,根据质子守恒可知所得溶液中:c(OH-)=c(H+)+c(CH3COOH),D不正确,答案选B。
【命题意图】本题主要是考查水溶液中的离子平衡以及溶液中离子浓度大小比较,题目难度较大。该类试题重点考查了学生对知识理解、综合运用能力,对离子浓度大小的比较的方法及三大守恒的掌握情况。意在考查学生分析、归纳、总结问题的能力。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是( )

A. 电池的负极反应为BH4--8e-+8OH-=BO2-+6H2O
B. 电池放电时Na+从b极区移向a极区
C. 电子从电极a经外电路流向电极b
D. 放电一段时间后,正负两极生成的OH-和消耗的OH-的量相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
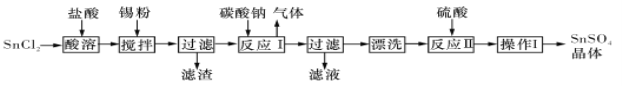
查阅资料:
A.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
B.SnC12易水解生成碱式氯化亚锡
回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式用平衡移动原理解释原因:___________。
(2)加入Sn粉的作用有两个:①调节溶液pH;②__________。
(3)反应I得到沉淀SnO,得到该沉淀的离子反应方程式是____________。
(4)操作I是____________。
II.已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-5 mol/L。若在10 mL含有KCl和KI各为0.01 mol/L的溶液中,加入16 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
c(K+)>c(NO![]() )>c(Cl-)>c(Ag+)>c(I-)
)>c(Cl-)>c(Ag+)>c(I-)
B .c(K+)>c(NO![]() )>c(Ag+)>c(Cl-)>c(I-)
)>c(Ag+)>c(Cl-)>c(I-)
C.c(K+)>c(NO![]() )>c(Ag+)=c(Cl-)+c(I-)
)>c(Ag+)=c(Cl-)+c(I-)
D.c(NO![]() )>c(K+)>c(Ag+)>c(Cl-)>c(I-)
)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )
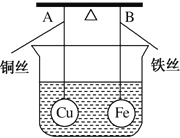
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用直流电电解下列各溶液一段时间后,溶液的颜色和密度保持不变的是
A. 用铜电极电解稀H2SO4 B. 用石墨电极电解Na2SO4溶液
C. 用铜电极电解CuCl2溶液 D. 铁为阳极,锌为阴极,电解ZnCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用药品羟苯水杨胺的合成路线如下。

已知:① ;
;
② ;
;
③当苯环上连有羧基,在苯环上引进的新取代基易进入羧基的间位。
回答下列问题:
(1)羟苯水杨胺的分子式为______,F含有的官能团名称是________。
(2)A的名称为___________。
(3)A→B所需试剂为______;D→E的反应类型属于_________。
(4)B→C反应的化学方程式为_____________。
(5)F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的共有_____种,其中能发生水解反应,核磁共振氢谱显示4组峰,其峰面积之比为l:2:2:1的同分异构体的结构简式是__________。
(6)写出以甲苯为原料(其他无机试剂任选)制备高聚物![]() 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,下列能大量共存的离子组是
A. S2O32-、Na+、Cl-、K+ B. Na+、Mg2+、Cl-、SO42-
C. Ba2+、Na+、SO42-、OH- D. K+、H2H5OH、MnO4-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)NH4NO3的水溶液呈 ____________(填“酸”、“中”、“碱”)性,常温时的pH_________7(填“>”、“=”、“<”),原因是(用离子方程式表示)_______________________;
(2)某温度下纯水中的C(H+ )= 2×10-7mol/L,则此时溶液中的C(OH-)=_________;若温度不变,滴入稀盐酸,使C(H+ )= 5×10-4mol/L,则溶液中C(OH-)=________,此时溶液中由水电离产生的C (H+)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈的《洗冤集录》中有一“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2 =2Ag2S+2H2O。该反应中H2S是
A. 氧化剂
B. 还原剂
C. 既是氧化剂又是还原剂
D. 既不是氧化剂又不是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com