
”¾ĢāÄæ”æ¼×“¼Č¼ĮĻµē³ŲĢå»żŠ””¢½ą¾»»·±£”¢ĄķĀŪÄÜĮæ±Čøߣ¬ŅŃŌŚ±ćŠÆŹ½ĶØѶÉč±ø”¢Ęū³µµČĮģÓņÓ¦ÓĆ”£Ä³¼×“¼Č¼ĮĻµē³ŲµÄ×Ü·“Ó¦Ź½2CH4O + 3O2= 2CO2+ 4H2O£¬ĻĀĶ¼ŹĒøĆČ¼ĮĻµē³ŲµÄŹ¾ŅāĶ¼”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. aŹĒ¼×“¼Č¼ĮĻ”¢bŹĒŃõĘų
B. µ±×ŖŅĘ6mole-Ź±£¬ĻūŗÄ33.6LO2
C. øŗ¼«·“Ó¦£ŗCH4O - 6e-+ H2O = CO2”ü+ 6H+
D. ÖŹ×Ó“ÓNµē¼«Ēų“©¹ż½»»»Ä¤ŅĘĻņMµē¼«Ēų
”¾“š°ø”æC
”¾½āĪö”æøĆČ¼ĮĻµē³ŲÖŠ£¬ĶØČėČ¼ĮĻµÄµē¼«ŹĒøŗ¼«”¢ĶØČėŃõ»Æ¼ĮµÄµē¼«ŹĒÕż¼«£¬øł¾ŻĶ¼Ę¬ÖŖ£¬µē½āÖŹČÜŅŗ³ŹĖįŠŌ£¬N¼«ÉĻÉś³ÉĖ®£¬ŌņaĪŖŃõĘų£¬NĪŖÕż¼«£¬MĪŖøŗ¼«£¬øŗ¼«·“Ó¦Ź½ĪŖCH40-6e-+H20=C02”ü+6H+£¬Õż¼«·“Ó¦Ź½ĪŖ02+4H++4e-=H20£¬bŹĒ¼×“¼”¢cŹĒ¶žŃõ»ÆĢ¼£¬ÖŹ×Ó“Óøŗ¼«ĶعżÖŹ×Ó½»»»Ä¤µ½Õż¼«£»A£®ĶعżŅŌÉĻ·ÖĪöÖŖ£¬aŹĒŃõĘų”¢bŹĒ¼×“¼£¬¹ŹA“ķĪó£»B£®Ć»ÓŠ±źĆ÷ĘųĢåµÄדĢ¬£¬²»ÖŖĘųĢåµÄĦ¶ūĢå»ż£¬ĪŽ·Øøł¾ŻĪļÖŹµÄĮæ¼ĘĖćĘųĢåµÄĢå»ż£¬¹ŹBÕżČ·£»C£®øŗ¼«ÉĻ¼×“¼Ź§µē×Ó·¢ÉśŃõ»Æ·“Ó¦£¬µē¼«·“Ó¦Ź½ĪŖCH4O-6e-+H2O=CO2”ü+6H+£¬¹ŹCÕżČ·£»D£®MŹĒøŗ¼«”¢NŹĒÕż¼«£¬ÖŹ×Ó“ÓMµē¼«Ēų“©¹ż½»»»Ä¤ĻņÕż¼«Nµē¼«ŅĘ¶Æ£¬¹ŹD“ķĪó£»¹ŹŃ”C”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠČČ»Æѧ·½³ĢŹ½ÖŠ£¬ÕżČ·µÄŹĒ
A£®¼×ĶéµÄČ¼ÉÕČČĪŖ890.3 kJ”¤mol£1£¬Ōņ¼×ĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½æɱķŹ¾ĪŖ
CH4(g)£«2O2(g)£½CO2(g)£«2H2O(g) ¦¤H£½£890.3 kJ”¤mol£1
B£®ŌŚ101 kPaŹ±£¬2 g H2ĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³ö285.8 kJČČĮ棬ĒāĘųČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½±ķŹ¾ĪŖ2H2(g)£«O2(g)£½2H2O(l) ¦¤H£½£571.6 kJ”¤mol£1
C£®HClŗĶNaOH·“Ó¦µÄÖŠŗĶČȦ¤H£½£57.3 kJ”¤mol£¬ŌņH2SO4ŗĶCa(OH)2·“Ó¦µÄÖŠŗĶČČ
¦¤H£½2”Į(£57.3)kJ”¤mol£1
D£®500”ę”¢30 MPaĻĀ£¬½«0.5 mol N2(g)ŗĶ1.5 mol H2(g)ÖĆÓŚĆܱÕČŻĘ÷ÖŠ³ä·Ö·“Ӧɜ³ÉNH3(g)·ÅČČ19.3 kJ£¬ĘäČČ»Æѧ·½³ĢŹ½ĪŖN2(g)£«3H2(g)![]() 2NH3(g) ¦¤H£½£38.6 kJ”¤mol£1
2NH3(g) ¦¤H£½£38.6 kJ”¤mol£1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNO2ÓėSO2ÄÜ·¢Éś·“Ó¦:NO2+SO2![]() SO3+NO,Ä³ŃŠ¾æŠ”×é¶Ō“Ė½ųŠŠĻą¹ŲŹµŃéĢ½¾æ”£
SO3+NO,Ä³ŃŠ¾æŠ”×é¶Ō“Ė½ųŠŠĻą¹ŲŹµŃéĢ½¾æ”£
(1)ŅŃÖŖ£ŗ2NO(g)+O2(g) ![]() 2NO2(g) ”÷H=-113.0 kJ mol-1
2NO2(g) ”÷H=-113.0 kJ mol-1
2SO2(g)+O2(g) ![]() 2SO3(g) ”÷H=-196. 6 kJ mol-1
2SO3(g) ”÷H=-196. 6 kJ mol-1
ŌņNO2(g)+SO2(g) ![]() SO3(g)+N0(g) ”÷H= ________.
SO3(g)+N0(g) ”÷H= ________.
(2)ŹµŃéÖŠ£¬Ī²ĘųæÉŅŌÓĆ¼īČÜŅŗĪüŹÕ”£NaOHČÜŅŗĪüŹÕN02Ź±£¬·¢ÉśµÄ·“Ó¦ĪŖ£ŗ
2NO2+2OH- =NO2- +NO3- +H2O,·“Ó¦ÖŠŠĪ³ÉµÄ»Æѧ¼üŹĒ________(Ģī»Æѧ¼üµÄĄąŠĶ£©£»ÓĆNaOHČÜŅŗĪüŹÕÉŁĮæSO2µÄĄė×Ó·½³ĢŹ½ĪŖ____________”£
(3)ŌŚ¹Ģ¶ØĢå»żµÄĆܱÕČŻĘ÷ÖŠ£¬Ź¹ÓĆijÖ֓߻ƼĮ£¬øıäŌĮĻĘųÅä±Č[n0(NO2) : n0 (SO2)] ½ųŠŠ¶ą×鏵Ńé(ø÷“ĪŹµŃéµÄĪĀ¶ČæÉÄÜĻąĶ¬£¬Ņ²æÉÄܲ»Ķ¬£©£¬²ā¶ØNO2µÄĘ½ŗā×Ŗ»ÆĀŹ[a(NO2)]”£ ²æ·ÖŹµŃé½į¹ūČēĶ¼ĖłŹ¾:
¢Łµ±ČŻĘ÷ÄŚ_______(Ģī±źŗÅ)²»ŌŁĖꏱ¼äµÄ±ä»Æ¶ųøı䏱£¬æÉŅŌ²»¶Ļ·“Ó¦“ļµ½ĮĖ»ÆŃ§Ę½ŗāדĢ¬”£
a.ĘųĢåµÄŃ¹Ēæ
b.ĘųĢåµÄĘ½¾łÄ¦¶ūÖŹĮæ
c.ĘųĢåµÄĆܶČ
d.NO2µÄĢå»ż·ÖŹż
¢ŚČē¹ūŅŖ½«Ķ¼ÖŠCµćµÄĘ½ŗāדĢ¬øıäĪŖBµćµÄĘ½ŗāדĢ¬£¬Ó¦²ÉČ”µÄ“ėŹ©ŹĒ________”£

¢ŪČōAµć¶ŌÓ¦ŹµŃéÖŠ£¬S02(g)µÄĘšŹ¼ÅضČĪŖc0 molL-1 £¬¾¹żt min“ļµ½Ę½ŗāדĢ¬£¬øĆŹ±¶Ī»Æѧ·“Ó¦ĖŁĀŹ![]() (N02)= _________molL-1min -1.
(N02)= _________molL-1min -1.
¢ÜĶ¼ÖŠC”¢DĮ½µć¶ŌÓ¦µÄŹµŃéĪĀ¶Č·Ö±šĪŖTcŗĶTd£¬Ķعż¼ĘĖćÅŠ¶Ļ£ŗ£ŗTc_____Td(Ģī”°£¾”±”¢”°=”±»ņ”°£¼”±£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĪŖĮĖŗĻĄķĄūÓĆ»ÆѧÄÜ£¬Č·±£°²Č«Éś²ś£¬»Æ¹¤Éč¼ĘŠčŅŖ³ä·Öæ¼ĀĒ»Æѧ·“Ó¦µÄ·“Ó¦ČČ£¬²¢²ÉČ”ĻąÓ¦“ėŹ©”£»Æѧ·“Ó¦µÄ·“Ó¦ČČĶس£ÓĆŹµŃé½ųŠŠ²ā¶Ø£¬Ņ²æɽųŠŠĄķĀŪĶĘĖć”£
£Ø1£©ŹµŃé²āµĆ£¬5g¼×“¼£ØCH3OH£©ŅŗĢåŌŚŃõĘųÖŠ³ä·ÖČ¼ÉÕÉś³É¶žŃõ»ÆĢ¼ĘųĢåŗĶŅŗĢ¬Ė®Ź±ŹĶ·Å³ö113.5kJµÄČČĮ棬Ōņ±ķŹ¾¼×“¼±ź×¼Č¼ÉÕČȵÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ ”£
£Ø2£©½ńÓŠČēĻĀĮ½øöČČ»Æѧ·½³ĢŹ½£ŗŌņa b£ØĢī”°£¾”±”¢”°£½”±»ņ”°£¼”±£©
H2(g)+ 1/2O2(g)£½H2O(g) ¦¤H1£½a kJ”¤mol-1
H2(g)+ 1/2O2(g)£½H2O(l) ¦¤H2£½b kJ”¤mol-1
£Ø3£©²šæŖ1molĘųĢ¬ĪļÖŹÖŠÄ³ÖÖ¹²¼Ū¼üŠčŅŖĪüŹÕµÄÄÜĮ潊¼üÄÜ”£“Ó»Æѧ¼üµÄ½Ē¶Č·ÖĪö£¬»Æѧ·“Ó¦µÄ¹ż³Ģ¾ĶŹĒ·“Ó¦ĪļµÄ»Æѧ¼üµÄĘĘ»µŗĶÉś³ÉĪļµÄ»Æѧ¼üµÄŠĪ³É¹ż³Ģ”£ŌŚ»Æѧ·“Ó¦¹ż³ĢÖŠ£¬²šæŖ»Æѧ¼üŠčŅŖĻūŗÄÄÜĮ棬ŠĪ³É»Æѧ¼üÓÖ»įŹĶ·ÅÄÜĮ攣
»Æѧ¼ü | H£H | N£H | N”ŌN |
¼üÄÜ/kJ”¤mol£1 | 436 | 391 | 945 |
ŅŃÖŖ·“Ó¦N2(g)£«3H2(g)![]() 2NH3(g) ”÷H£½a kJ”¤mol£1”£ŹŌøł¾Ż±ķÖŠĖłĮŠ¼üÄÜŹż¾Ż¹ĄĖćaµÄÖµ£ŗ_______________(×¢Ć÷”°+”±»ņ”°£”±)”£
2NH3(g) ”÷H£½a kJ”¤mol£1”£ŹŌøł¾Ż±ķÖŠĖłĮŠ¼üÄÜŹż¾Ż¹ĄĖćaµÄÖµ£ŗ_______________(×¢Ć÷”°+”±»ņ”°£”±)”£
£Ø4£©ŅĄ¾ŻøĒĖ¹¶ØĀÉæÉŅŌ¶ŌijŠ©ÄŃŅŌĶعżŹµŃéÖ±½Ó²ā¶ØµÄ»Æѧ·“Ó¦µÄ·“Ó¦ČČ½ųŠŠĶĘĖć”£ĄūÓĆĖ®ĆŗĘųŗĻ³É¶ž¼×ĆѵÄČż²½·“Ó¦ČēĻĀ£ŗ
¢Ł 2H2(g) + CO(g)![]() CH3OH(g)£»¦¤H £½£90.8 kJ”¤mol£1
CH3OH(g)£»¦¤H £½£90.8 kJ”¤mol£1
¢Ś 2CH3OH(g)![]() CH3OCH3(g) + H2O(g)£»¦¤H£½£23.5 kJ”¤mol£1
CH3OCH3(g) + H2O(g)£»¦¤H£½£23.5 kJ”¤mol£1
¢Ū CO(g) + H2O(g)![]() CO2(g) + H2(g)£»¦¤H£½£41.3 kJ”¤mol£1
CO2(g) + H2(g)£»¦¤H£½£41.3 kJ”¤mol£1
×Ü·“Ó¦£ŗ3H2(g) + 3CO(g)![]() CH3OCH3(g) + CO2(g)µÄ¦¤H£½ £»
CH3OCH3(g) + CO2(g)µÄ¦¤H£½ £»
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃĒĻõĖįÄĘŹĒŅ»ÖÖ¹¤ŅµŃĪ£¬Ķā¹ŪÓėŹ³ŃĪ·Ē³£ĻąĖĘ£¬¶¾ŠŌ½ĻĒ攣
¢ń.¾²é£ŗ¢ŁKsp(AgNO2)=2”Į10£8£¬Ksp(AgCl)=1.8”Į10£10£»¢ŚKa(HNO2)=5.1”Į10£4”£ĒėÉč¼Ę×ī¼ņµ„µÄ·½·Ø¼ų±šNaNO2ŗĶNaClĮ½ÖÖ¹ĢĢå______________________
¢ņ. ijŠ”×éĶ¬Ń§ÓĆČēĻĀ×°ÖĆ£ØĀŌČ„¼Š³ÖŅĒĘ÷£©ÖʱøŃĒĻõĖįÄĘ
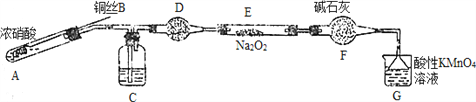
ŅŃÖŖ£ŗ¢Ł2NO£«Na2O2=2NaNO2£» ¢ŚĖįŠŌĢõ¼žĻĀ£¬NOŗĶNO2¶¼ÄÜÓėMnO4£·“Ӧɜ³ÉNO3£ŗĶMn2£«”£
£Ø1£©Ź¹ÓĆĶĖæµÄÓŵćŹĒ________________________”£
£Ø2£©×°ÖĆAÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ_____________________________”£
×°ÖĆCÖŠŹ¢·ÅµÄŅ©Ę·ŹĒ_________£»£ØĢī×ÖÄø“śŗÅ£©
A£®ÅØĮņĖį B£®NaOHČÜŅŗ C£®Ė® D£®ĖÄĀČ»ÆĢ¼
£Ø3£©øĆŠ”×é³ĘČ”5.000gÖĘČ”µÄѳʷČÜÓŚĖ®Åä³É250mlČÜŅŗ£¬Č”25.00mlČÜŅŗӌ׶ŠĪĘæÖŠ£¬
ÓĆ0.1000mol”¤L£1ĖįŠŌKMnO4ČÜŅŗ½ųŠŠµĪ¶Ø£¬ŹµŃéĖłµĆŹż¾ŻČēĻĀ±ķĖłŹ¾£ŗ
µĪ¶Ø“ĪŹż | 1 | 2 | 3 | 4 |
ĻūŗÄKMnO4ČÜŅŗĢå»ż/mL | 20.90 | 20.12 | 20.00 | 19.88 |
¢ŁµŚŅ»“ĪŹµŃ鏿¾Ż³öĻÖŅģ³££¬Ōģ³ÉÕāÖÖŅģ³£µÄŌŅņæÉÄÜŹĒ_________£ØĢī×ÖÄø“śŗÅ£©”£
a£®×¶ŠĪĘæĻ“¾»ŗóĪ“øÉŌļ
b£®ĖįŹ½µĪ¶Ø¹ÜÓĆÕōĮóĖ®Ļ“¾»ŗóĪ“ÓƱź×¼ŅŗČóĻ“
c£®µĪ¶ØÖÕµćŹ±ŃöŹÓ¶ĮŹż
¢ŚĖįŠŌKMnO4ČÜŅŗµĪ¶ØŃĒĻõĖįÄĘČÜŅŗµÄĄė×Ó·½³ĢŹ½ĪŖ___________________”£
¢ŪøĆѳʷ֊ŃĒĻõĖįÄʵÄÖŹĮæ·ÖŹżĪŖ______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮņĖįŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤²śĘ·£¬ÄæĒ°Ö÷ŅŖ²ÉÓĆ”°½Ó“„·Ø”±½ųŠŠÉś²ś£®ĻĀĮŠ¶ŌÓŚ·“Ó¦ 2SO2+O2 ![]() 2SO3µÄĖµ·ØÖŠÕżČ·µÄŹĒ( )
2SO3µÄĖµ·ØÖŠÕżČ·µÄŹĒ( )
A. Ö»ŅŖŃ”ŌńŹŹŅĖµÄĢõ¼ž£¬SO2ŗĶO2¾ĶÄÜČ«²æ×Ŗ»ÆĪŖSO3
B. ŌŚ¹¤ŅµŗĻ³ÉSO3Ź±£¬ŅŖĶ¬Ź±æ¼ĀĒ·“Ó¦ĖŁĀŹŗĶ·“Ó¦ÄÜ“ļµ½µÄĻŽ¶ČĮ½·½ĆęµÄĪŹĢā
C. øĆ·“Ó¦“ļµ½Ę½ŗāŗ󣬷“Ó¦¾ĶĶźČ«Ķ£Ö¹ĮĖ£¬¼“ÕżÄę·“Ó¦ĖŁĀŹ¾łĪŖĮć
D. ŌŚ“ļµ½Ę½ŗāµÄĢåĻµÖŠ£¬³äČėÓÉ18OŌ×Ó×é³ÉµÄO2ŗó£¬18O½ö“ęŌŚÓŚSO2ŗĶSO3ÖŠ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ꏱ£¬0.1molNa2CO3ÓėŃĪĖį»ģŗĻĖłµĆµÄŅ»×éĢå»żĪŖ1LµÄČÜŅŗ£¬ČÜŅŗÖŠ²æ·ÖĪ¢Į£ÓėpHµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠÓŠ¹ŲČÜŅŗÖŠĄė×ÓÅØ¶Č¹ŲĻµŠšŹöÕżČ·µÄŹĒ
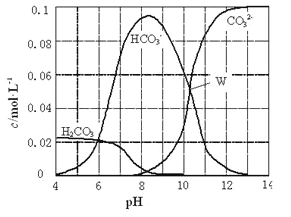
A. WµćĖłŹ¾µÄČÜŅŗÖŠ£ŗc (Na+)+c (H+)£½2c(CO32-)+c (OH-)+c (Cl-)
B. pH=8µÄČÜŅŗÖŠ£ŗc (H+)+c (H2CO3)+c (HCO3-)£½ c (OH-)+c (Cl-)
C. pH= 4µÄČÜŅŗÖŠ£ŗc (H2CO3)+c (HCO3-)+c (CO32-)£¼0.1mol”¤L-1
D. pH=11µÄČÜŅŗÖŠ£ŗc (Na+)£¾c (Cl-)£¾c (CO32-)£¾c (HCO3-)£¾c (H2CO3)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµŖµÄ»ÆŗĻĪļŌŚÉś²śÉś»īÖŠ¹ć·ŗ“ęŌŚ”£
£Ø1£©¢ŁĀČ°·£ØNH2Cl£©µÄµē×ÓŹ½ĪŖ ”£æÉĶعż·“Ó¦NH3(g)£«Cl2(g)=NH2Cl(g)£«HCl(g)ÖʱøĀČ°·£¬ŅŃÖŖ²æ·Ö»Æѧ¼üµÄ¼üÄÜČēĻĀ±ķĖłŹ¾£Ø¼Ł¶Ø²»Ķ¬ĪļÖŹÖŠĶ¬ÖÖ»Æѧ¼üµÄ¼üÄÜŅ»Ńł£©£¬ŌņÉĻŹö·“Ó¦µÄ¦¤H= ”£
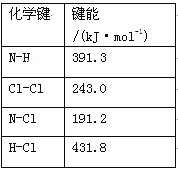
¢ŚNH2ClÓėĖ®·“Ӧɜ³ÉĒæŃõ»ÆŠŌµÄĪļÖŹ£¬æÉ×÷³¤Š§»ŗŹĶĻū¶¾¼Į£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø2£©ÓĆ½¹Ģ滹ŌNOµÄ·“Ó¦ĪŖ£ŗ2NO(g)+C(s) ![]() N2(g)+CO2(g)£¬ĻņČŻ»ż¾łĪŖ1 LµÄ¼×”¢ŅŅ”¢±ūČżøöŗćČŻŗćĪĀ£Ø·“Ó¦ĪĀ¶Č·Ö±šĪŖ400”ę”¢400”ę”¢T”ę£©ČŻĘ÷ÖŠ·Ö±š¼ÓČė×ćĮæµÄ½¹ĢæŗĶŅ»¶ØĮæµÄNO£¬²āµĆø÷ČŻĘ÷ÖŠn(NO)Ėę·“Ó¦Ź±¼ätµÄ±ä»ÆĒéæöČēĻĀ±ķĖłŹ¾£ŗ
N2(g)+CO2(g)£¬ĻņČŻ»ż¾łĪŖ1 LµÄ¼×”¢ŅŅ”¢±ūČżøöŗćČŻŗćĪĀ£Ø·“Ó¦ĪĀ¶Č·Ö±šĪŖ400”ę”¢400”ę”¢T”ę£©ČŻĘ÷ÖŠ·Ö±š¼ÓČė×ćĮæµÄ½¹ĢæŗĶŅ»¶ØĮæµÄNO£¬²āµĆø÷ČŻĘ÷ÖŠn(NO)Ėę·“Ó¦Ź±¼ätµÄ±ä»ÆĒéæöČēĻĀ±ķĖłŹ¾£ŗ
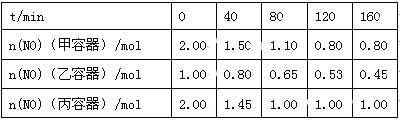
¢ŁøĆ·“Ó¦ĪŖ £ØĢī”°·ÅČČ”±»ņ”°ĪüČČ”±£©·“Ó¦”£
¢ŚŅŅČŻĘ÷ŌŚ200 min“ļµ½Ę½ŗāדĢ¬£¬Ōņ0”«200 minÄŚÓĆNOµÄÅØ¶Č±ä»Æ±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹv(NO)= ”£
£Ø3£©ÓĆ½¹Ģ滹ŌNO2µÄ·“Ó¦ĪŖ£ŗ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)£¬ŌŚŗćĪĀĢõ¼žĻĀ£¬1 mol NO2ŗĶ×ćĮæC·¢ÉśøĆ·“Ó¦£¬²āµĆĘ½ŗāŹ±NO2ŗĶCO2µÄĪļÖŹµÄĮæÅضČÓėĘ½ŗā×ÜŃ¹µÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ
N2(g)+2CO2(g)£¬ŌŚŗćĪĀĢõ¼žĻĀ£¬1 mol NO2ŗĶ×ćĮæC·¢ÉśøĆ·“Ó¦£¬²āµĆĘ½ŗāŹ±NO2ŗĶCO2µÄĪļÖŹµÄĮæÅضČÓėĘ½ŗā×ÜŃ¹µÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ
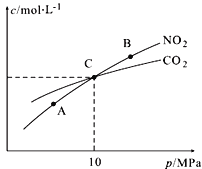
¢ŁA”¢BĮ½µćµÄÅضČĘ½ŗā³£Źż¹ŲĻµ£ŗKc(A) Kc(B)£ØĢī”°£¼”±»ņ”°£¾”±»ņ”°=”±£©”£
¢ŚA”¢B”¢CČżµćÖŠNO2µÄ×Ŗ»ÆĀŹ×īøߵďĒ £ØĢī”°A”±»ņ”°B”±»ņ”°C”±£©µć”£
¢Ū¼ĘĖćCµćŹ±øĆ·“Ó¦µÄŃ¹ĒæĘ½ŗā³£ŹżKp(C)= £ØKpŹĒÓĆĘ½ŗā·ÖŃ¹“śĢęĘ½ŗāÅØ¶Č¼ĘĖć£¬·ÖŃ¹£½×ÜŃ¹”ĮĪļÖŹµÄĮæ·ÖŹż£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲÓŚ×é³ÉÉśĪļĢå»ÆѧŌŖĖŲµÄĀŪŹö£¬ÕżČ·µÄŹĒ
A. ×é³ÉÉśĪļĢåµÄ»ÆѧŌŖĖŲÖŠ£¬Ģ¼ŌŖĖŲŗ¬Įæ×ī¶ą
B. ¶ÆĪļŗĶÖ²ĪļĖłŗ¬µÄ»ÆѧŌŖĖŲµÄÖÖĄą²īŅģŗÜ“ó
C. ĪŽ»ś×ŌČ»½ēÖŠµÄŌŖĖŲ¶¼æÉŅŌ²ĪÓė×é³ÉÉśĪļĢå
D. Ī¢ĮæŌŖĖŲŹĒĪ¬³ÖÕż³£ÉśĆü»ī¶Æ²»æÉȱɣµÄ
²éæ““š°øŗĶ½āĪö>>
¹ś¼ŹŃ§Š£ÓÅŃ” - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com