
【题目】下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
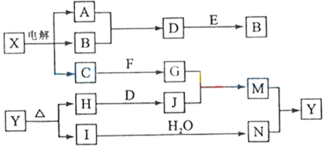
请回答下列问题:
(1)A在B中燃烧的现象是__________________________________________。
(2)D+E→B的反应中,被氧化与被还原的物质的物质的量比是_________________________。
(3)G+J→M的离子方程式是____________________________________。
(4)Y受热分解的化学方程式是______________________________________。
(5)检验硫酸铁溶液中是否存在Fe2+的试剂是 ____________________。
【答案】放出大量的热,产生苍白色火焰 2:1 3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓ 4Fe(NO3)3![]() 2Fe2O3+12NO2↑+3O2↑ 酸性高锰酸钾溶液
2Fe2O3+12NO2↑+3O2↑ 酸性高锰酸钾溶液
【解析】
F是地壳中含量最多的金属元素的单质,则F为Al,转化关系中X电解得到三种物质,为电解电解质与水型,A、B为气态单质,二者为氢气和氯气,二者反应生成D,D为HCl,E为黑色固体,为氧化物,和HCl反应又生成B气体,A为H2,B为Cl2,E为MnO2,电解X是电解氯化钠溶液,C为NaOH,与Al反应生成G,G为NaAlO2;M为红褐色沉淀为Fe(OH)3,所以J是含三价铁离子的物质,是H和D反应生成,证明J为FeCl3,H、I为氧化物判断H为Fe2O3,I为红棕色气体为NO2,结合转化关系可知,N为HNO3,Y为Fe(NO3)3,结合物质的性质来解答。
(1) A为H2,B为Cl2,H2在Cl2中燃烧的现象是:气体安静燃烧,放出大量的热,火焰呈苍白色,并有白雾产生;
(2) D+E→B的反应为MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,MnO2中Mn元素化合价降低,被还原,HCl 中Cl元素化合价升高,被氧化,4mol盐酸参与反应,发生氧化反应的盐酸为2mol,另外2mol盐酸显酸性,则n(被氧化的物质HCl):n(被还原的物质MnO2)=2:1;
MnCl2+Cl2↑+2H2O,MnO2中Mn元素化合价降低,被还原,HCl 中Cl元素化合价升高,被氧化,4mol盐酸参与反应,发生氧化反应的盐酸为2mol,另外2mol盐酸显酸性,则n(被氧化的物质HCl):n(被还原的物质MnO2)=2:1;
(3) G(NaAlO2)+J(FeCl3)→M(Fe(OH)3)的反应是在水溶液中发生的双水解反应,反应离子方程式是:3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓;
(4)依据分析推断可知Y为Fe(NO3)3,受热分解生成二氧化氮和氧化铁,依据原子守恒配平书写的化学方程式是:4Fe(NO3)3![]() 2Fe2O3+12NO2↑+3O2↑;
2Fe2O3+12NO2↑+3O2↑;
(5)检验硫酸铁溶液中是否存在Fe2+的方法是取少量待测液于试管中,滴加几滴酸性高锰酸钾溶液,若溶液紫色褪去,证明原溶液中含有Fe2+,反之没有Fe2+。


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】乙醇(CH3CH2OH)既是生活中常见的有机物,又是重要的化工原料。
(1)工业上可用乙烯制备乙醇的化学方程式为:CH2 = CH2+H2O![]() CH3CH2OH,该反应属于____反应(填“加成”或“取代”)。
CH3CH2OH,该反应属于____反应(填“加成”或“取代”)。
(2)官能团决定有机物的性质。乙醇中含有的官能团名称是______。
(3)为探究乙醇的性质,某学生向试管中加入3mL乙醇,将下端绕成螺旋状的铜丝在酒精灯火焰上灼烧至红热后,迅速插入乙醇中,可观察到铜丝表面由黑色变成红色,说明乙醇具有______性。
(4)萃取是物质分离的一种方法。某学生拟用乙醇萃取溴水中的Br2,判断该方法是否可行:_____(填“是”或“否”),判断的理由是________。
(5)某液态有机物不溶于水,将它和水分离开来的方法是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一无色透明溶液,欲确定是否含有下列离子:
Na+、Mg2+、Al3+、Fe2+、Ba2+、NO![]() 、SO
、SO![]() 、Cl-、SO32-、HCO
、Cl-、SO32-、HCO![]() ,取该溶液进行以下实验:
,取该溶液进行以下实验:
①取少量待测液,加入几滴石蕊试液,溶液呈红色。
②取少量待测液,浓缩后加入铜片和浓硫酸,加热,有无色气体产生,此无色气体遇空气变成红棕色。
③取少量待测液,加入BaCl2溶液,有白色沉淀产生。
④取实验③中上层清液滴加AgNO3溶液,有白色沉淀产生,此沉淀不溶于稀硝酸。
⑤另取少量原溶液滴加NaOH溶液,有白色沉淀产生,当NaOH过量时,沉淀部分溶解。
(1)根据以上实验,溶液中肯定存在的离子是_________________;肯定不存在的离子是______________;尚不能确定的离子是_______________。
(2)写出②中有关反应的离子方程式:________________________________________。
(3)写出⑤中沉淀溶解的离子方程式:________________________________________。
(4)实验室检验Na+一般用焰色反应即可确定,此实验做之前要用______清洗铂丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验装置探究硫酸与金属、非金属的反应、验证其产物,并探究随着反应的进行,硫酸性质发生的变化。根据实验要求回答相关问题:

F装置用于检验二氧化碳。供选择的试剂有:只含碳的生铁、18 mol·L-1的硫酸、品红溶液、无水硫酸铜粉未、酸性高锰酸钾溶液、氧化铜、澄清的石灰水、碱石灰。(供选择的试剂可重复使用)
(1)打开分液漏斗的活塞,A装置中发生的反应6H2SO4(浓)+2Fe![]() Fe2(SO4)3+6H2O↑+3SO2↑和(用化学方程式表示)_____,随反应的进行,硫酸的浓度变稀,又发生反应(用化学方程式表示)____
Fe2(SO4)3+6H2O↑+3SO2↑和(用化学方程式表示)_____,随反应的进行,硫酸的浓度变稀,又发生反应(用化学方程式表示)____
(2)B装置中的试剂是__________。
(3)E装置中的试剂是____________作用是______________。
(4)G装置中的试剂是__________,现象是______________。
(5)制备SO2的适宜药品为___________(填代号)。
①Na2SO3固体;②Na2SO3溶液;③20%硫酸;④70%硫酸;⑤铜片
(6)对SO2与氯水的反应进行探究。用注射器吸入一定量的饱和氯水和SO2,振荡,静置,再吸入少量品红溶液,发现品红溶液不褪色,用化学反应方程式解释其原因____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯),下列说法正确的是( )
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③实验②生成的溶液滴在KI试纸上,试纸变蓝
下列判断正确的是( )
A.上述实验证明氧化性:![]() >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
B.上述实验中共有两个氧化还原反应
C.实验①生成的气体不能使湿润的KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种常见的氨基酸,其合成路线如下
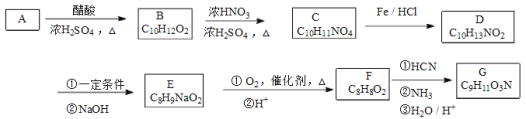
已知以下信息:
①A苯环上只有1个取代基且核磁共振氢谱有6组峰,其面积比为1∶2∶2∶2∶2∶1;D和F的苯环上的一氯代物都只有2种;
②F、G能与FeCl3溶液发生显色反应,F能发生银镜反应;
③![]()
④
回答下列问题
(1)A的分子式为__________,其名称为__________。
(2)A→B的反应类型是__________;鉴别A和B可用的试剂是__________。
(3)B→C的化学方程式为________________________。
(4)G的结构简式为__________。
(5)F的同分异构构体,含有苯环且能发生水解反应的异构体有__________种,其中核磁共振氢谱有4组峰,且面积比为3:2:2:1的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对人类生存具有重大意义,反应为:N2(g)+3H2(g)![]() 2NH3(g)△H
2NH3(g)△H
(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。

①NH3的电子式是___。
②决定反应速率的一步是___(填字母a、b、c、…)。
③由图象可知合成氨反应的△H____0(填“>”、“<”或“=”)。
(2)传统合成氨工艺是将N2和H2在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入5molN2、15molH2,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:

①温度T1、T2、T3大小关系是___。
②M点的平衡常数K=____(可用分数表示)。
(3)目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如图:

①导线中电子移动方向是____。
②固氮酶区域发生反应的离子方程式是___。
③相比传统工业合成氨,该方法的优点有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】企鹅酮的化学式C10H14O,因为结构类似企鹅,因此命名为企鹅酮(见图)。下列有关企鹅酮的说法正确的是

A.分子式为C10H16O
B.1 mol企鹅酮分子最多可以和2 mol氢气加成
C.可使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同
D.企鹅酮的同分异构体众多,其中遇Fe3+显色且苯环上有两个支链的结构共有12种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com