
光气( COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与C12在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2 和CO的燃烧热(△H)分别为−890.3kJ∙mol−1、−285. 8 kJ∙mol−1和−283.0 kJ∙mol−1,则生成1m3(标准状况)CO所需热量为 :
(3)实验室中可用氯仿(CHC13)与双氧水直接反应制备光气,其反应的化学方程式为 ;
(4)COCl2的分解反应为COCl2(g)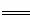 Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体
Cl2(g)+CO(g) △H=+108kJ·mol-1 。反应体
系达到平衡后,各物质的浓度在不同条件下的变化状况如下同所示(第10min到14min
的COCl2浓度变化曲线未示出):


①计算反应在第8 min时的平衡常数K= ;
②比较第2 min反应温度T(2)与第8min反应温度T(8)的高低:T(2) ____ T(8)(填“<”、“>”或“=”);
③若12min时反应于温度T(8)下重新达到平衡,则此时c (COCl2)= mol·L-1;
(COCl2)= mol·L-1;
④比教产物CO在2−3 min、5−6 min和12−13 min时平均反应速率[平均反应速率分别以v(2−3)、v(5−6)、v(12−13)表示]的大小 ;
⑤比较反应物COCl2在5−6min和15−16 min时平均反应速率的大小: v(5−6) v(15−16)(填“<”、“>”或“=”),原因是 。
科目:高中化学 来源: 题型:
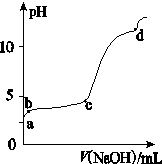 (Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示。
(Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示。
(1)写出a点溶液呈酸性的离子方程式:
(2)若c点时V(NaOH)为90ml,则Al2(SO4)3溶液的物质的量浓度约为:
(3)写出b~c段反应的离子方程式: ,
(4) d点时,V(NaOH)约为 

(Ⅱ)常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1) 向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”或“不变”)。
(2)若将③和④的溶液混合后溶液恰好呈中性则混合 前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是( )
A.向Ba(OH)2溶液中滴加稀硫酸:
Ba2++2OH-+2H++SO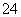 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
B.酸性介质中KMnO4氧化H2O2:
2MnO +5H2O2+6H+===2Mn2++5O2↑+8H2O
+5H2O2+6H+===2Mn2++5O2↑+8H2O
C.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-===PbO2+4H++SO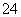
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:
①CO(g)+ 2H2(g)=CH3OH(g) △H1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
水煤气变换反应:
③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=-41.1 kJ·mol-1
二甲醚合成反应:
④2CH 3OH(g)=CH3OCH3(g)+H2O(g) △H4=-24.5 kJ·mol-1
3OH(g)=CH3OCH3(g)+H2O(g) △H4=-24.5 kJ·mol-1
⑴Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是 (以化学方程式表示) 。
⑵分析二 甲醚合成反应④对于CO转化率的影响 。
甲醚合成反应④对于CO转化率的影响 。
⑶由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
⑷有研究者在催化剂(含Cu-Zn-Al-O和Al2O3),压强为5.0MPa的条件下由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是____________。
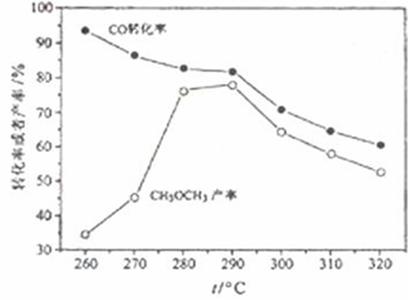
⑸二甲醚直接燃料电池具有启动快,效率高等优点,其能量密度高于甲醇直接燃烧燃料电池(5.93kW·h·kg-1),若电解质为酸性,二甲醚直接燃料电池的负极反应为_______________。
一个二甲醚分子经过电化学氧化,可以产生_______个电子的电量;该电池理论输出电压1.20V,能量密度E=_____(列式计算,能量密度=电池输出电能/燃料质量,1kW·h=3.6×105J )
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
①HF(aq)+OH—(aq)=F—(aq)+H2O(l) △H=—67.7KJ·mol—1
②H+(aq)+OH—(aq)=H2O(l) △H=—57.3KJ·mol—1
在20mL0.1·molL—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A.氢氟酸的电离方程式及热效应可表示为:
HF(aq)=H+(aq) +F−(aq) △H=+10.4KJ·mol—1
B.当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C.当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D.当V >0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2 Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7 kJ·mol-1
C. -259.7 kJ·mol-1 D. -519.4kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各表述与示意图一致的是
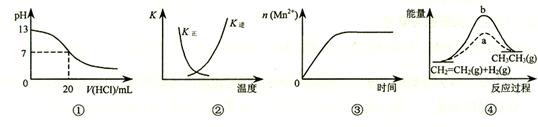
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在给定条件下能大量共存的是 ( )
A.在c(HCO)=0.1 mol·L-1的溶液中:NH、Al3+、Cl-、NO
B.有大量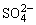 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有大量 存在的强酸性溶液中:NH、Ba2+、Fe2+、Br-
存在的强酸性溶液中:NH、Ba2+、Fe2+、Br-
D.能使红色石蕊试纸变蓝的溶液中:SO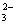 、S2-、Na+、K+
、S2-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
能用H++OH- = H2O表示的是 ( )
A.Ba(OH)2溶液和稀H2SO4的反应 B.NaOH溶液和盐酸反应
C.Cu(OH)2和稀H2SO4的反应 D.NaOH溶液和CO2的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com