
【题目】已知:![]() 时
时
化学式 |
|
|
|
电离平衡常数 |
|
|
|
下列说法正确的是 ( )
A. 醋酸稀释过程中,![]() 逐渐减小
逐渐减小
B. ![]() 溶液中:
溶液中:![]()
C. 向醋酸或HCN溶液中加入![]() ,均产生
,均产生![]()
D. 物质的量浓度相同时![]()
【答案】D
【解析】
根据稀释过程中电离平衡的移动方向、HCO3-在溶液中电离与水解的主次关系、弱酸的相对强弱及对应盐的碱性强弱等分析解答。
A项:醋酸稀释过程中,醋酸电离平衡右移,![]() 逐渐增大,A项错误;
逐渐增大,A项错误;
B项:HCO3-电离常数为5.6×10-11,HCO3-水解常数为10-14/(4.4×10-7)=2.3×10-8,故![]() 溶液中,HCO3-以水解为主,c(H2CO3)>c(CO32-),B项错误;
溶液中,HCO3-以水解为主,c(H2CO3)>c(CO32-),B项错误;
C项:表中电离常数说明,酸性![]() >
>![]() >
>![]() >HCO3-,据较强酸生成较弱酸的规律,醋酸与
>HCO3-,据较强酸生成较弱酸的规律,醋酸与![]() 反应可产生
反应可产生![]() ,HCN与
,HCN与![]() 反应只可生成NaHCO3,C项错误;
反应只可生成NaHCO3,C项错误;
D项:由酸性强弱得,对应盐的碱性强弱CH3COO-<HCO3-<CN-<CO32-,当溶液物质的量浓度相同时,有![]() ,D项正确。
,D项正确。
本题选D。


科目:高中化学 来源: 题型:
【题目】20℃时,将足量的BaSO4固体溶于50mL水中,充分搅拌,慢慢加入Na2CO3固体,搅拌,溶液中随c(CO32-)增大时c(Ba2+)变化曲线如下图。则下列说正确的是

A. 20℃时Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(CO32-):c(SO42-)=25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
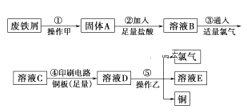
请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是_____。
(2)步骤②中,除发生反应Fe+2HCl=FeCl2+H2↑外,其他可能反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O和____。
(3)溶液C的颜色是____,溶液D中可能含有的金属阳离子有___。
(4)可以验证溶液B中是否含有Fe2+的一种试剂是____(填选项序号)。
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液
(5)操作乙的名称是___,步骤⑤产生金属铜的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有化合物:
甲: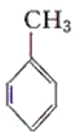 乙:
乙: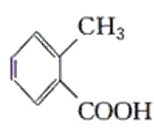 丙:
丙: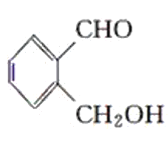
(1)请判别上述哪些化合物互为同分异构体(填序号):____________。
(2)请用一种试剂鉴别甲、乙、丙化合物。在下表中填入所选试剂及主要现象即可。________
试剂 | 现象 | |
甲 | ||
乙 | ||
丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
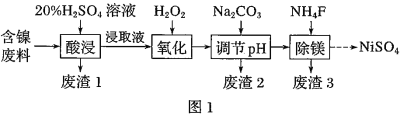
【题目】某含镍![]() 废料中有FeO、
废料中有FeO、![]() 、MgO、
、MgO、![]() 等杂质,用此废料提取
等杂质,用此废料提取![]() 的工艺流程如图1:
的工艺流程如图1:
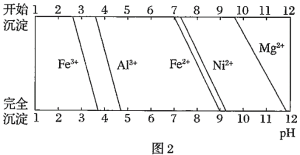
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图.
②![]() 时,
时,![]() 的电离常数
的电离常数![]() 的电离常数
的电离常数![]() ,
,![]()
![]() .
.
(1)加![]() 调节溶液的pH至5,得到废渣2的主要成分是______
调节溶液的pH至5,得到废渣2的主要成分是______![]() 填化学式
填化学式![]() .
.
(2)![]() 能与饱和
能与饱和![]() 溶液反应产生
溶液反应产生![]() ,请用化学平衡移动原理解释
,请用化学平衡移动原理解释![]() 用必要的文字和离子方程式回答
用必要的文字和离子方程式回答![]() ______.
______.
(3)![]() 时,
时,![]() 的NaF溶液中
的NaF溶液中![]() ______
______![]() 列出计算式即可
列出计算式即可![]() 溶液呈______
溶液呈______![]() 填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性”![]() .
.
(4)已知沉淀前溶液中![]() ,当除镁率达到
,当除镁率达到![]() 时,溶液中
时,溶液中![]() ______
______![]() .
.
(5)在NaOH溶液中用NaClO与![]() 反应可得
反应可得![]() ,化学方程式为____________;
,化学方程式为____________;![]() 与贮氢的镧镍合金可组成镍氢碱性电池
与贮氢的镧镍合金可组成镍氢碱性电池![]() 溶液
溶液![]() ,工作原理为:
,工作原理为:![]() ,负极的电极反应式:______.
,负极的电极反应式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于0.1mol/L Na2CO3溶液,下列判断不正确的是
A.粒子种类与NaHCO3溶液相同
B.升高温度,c(CO32-)增大
C.加入CaCl2溶液,c(CO32-)减小
D.c(H+)+c(Na+)=2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
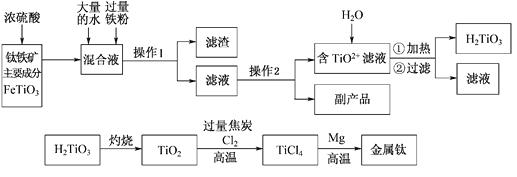
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有________________________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_____________________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是___________________________________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是_____________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 I( )是治疗心脏病的一种重要药物,可由简单有机物 A、B 和萘(
)是治疗心脏病的一种重要药物,可由简单有机物 A、B 和萘(  )合成,路线如下:
)合成,路线如下:

(1)C的结构简式为_________,E的化学名称_______。
(2)由萘生成C、B生成E的反应类型分别为_________、_________ 。
(3)I中含氧官能团的名称为_______。
(4)D可使溴水褪色,由D生成G的反应实现了原子利用率100%,则该反应的化学方程式为_______________。
(5)同位素标记可用来分析有机反应中的断键情况,若用超重氢(T)标记的
G( )与F反应,所得H的结构简式为
)与F反应,所得H的结构简式为  则反应中G(
则反应中G( )断裂的化学键为 _______(填编号)
)断裂的化学键为 _______(填编号)
(6)Y为H的同分异构体,满足以下条件的共有______种,请写出其中任意一种的结构简式_________。
①含有萘环,且环上只有一个取代基。
②可发生水解反应,但不能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
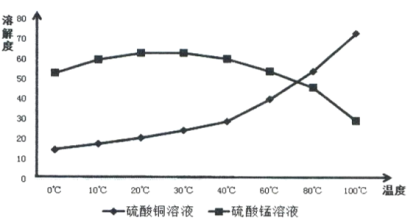
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分MnO2,它们都含有少量Fe2O3、SiO2等杂质。工业上综合利用这两种矿物制备硫酸铜、硫酸锰和硫单质的主要工艺流程如下:
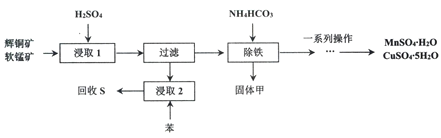
(1)浸取2过程中温度控制在500C~600C之间的原因是__________________。
(2)硫酸浸取时,Fe3+对MnO2氧化Cu2S起着重要催化作用,该过程可能经过两岁反应完成,将其补充完整:
①_____________________________(用离子方程式表示)
②MnO2+2Fe2++4H+= Mn2++2Fe3++2H2O
(3)固体甲是一种碱式盐,为测定甲的化学式,进行以下实验:
步骤1:取19.2 g固体甲,加足量的稀盐酸溶解,将所得溶液分为A、B两等份;
步骤2:向A中加入足量的NaOH溶液并加热,共收集到0.448L NH3(标准状况下)过滤后将所得滤渣洗涤干燥并灼烧至质量不再变化,可得4.80g红棕色固体残渣:
步骤3:向B中加入足量的BaCl2溶液,过滤、洗涤、干燥,可得9.32g固体残渣。
则固体甲的化学式为_________________
(4)相关物质的溶解度如下图,从除铁后的溶液中通过一系列的操作分别获得硫酸铜、硫酸锰晶体,请给出合理的操作顺序(从下列操作中选取,按先后次序列出字母,操作可重复使用):溶液→( ) →( )→( ) →(A) →( ) →( ) →( ),_____________
A.蒸发溶剂 B.趁热过滤 C.冷却结晶 D.过滤
E.将溶液蒸发至溶液表面出现晶膜 F.将溶液蒸发至容器底部出现大量晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com