
����Ŀ��ԭ���������ε����Ҷ�С��36��A��B��C��D��E����Ԫ�أ�����A��һ�ֺ�����û�����ӣ�Bԭ�ӻ�̬ʱ���������������ڲ��������2����Dԭ�ӻ�̬ʱ2pԭ�ӹ������2��δ�ɶԵĵ��ӣ�EԪ�ص�ԭ�ӽṹ��3d�ܼ���δ�ɶԵ������dzɶԵ�������2�����ش��������⣺
��1��B2A4������Bԭ�ӹ�����ӻ�����Ϊ ��B2A4�����ЦҼ��ͦм�������Ϊ ��
��2��A��B��C��D����Ԫ�صĵ縺�ԴӴ�С��˳��Ϊ______________����Ԫ�ط��ű�ʾ����������CA3�ķе�Ȼ�����BA4�ĸߣ�����Ҫԭ���� ��
��3��Ԫ��B��һ����������Ԫ��C��һ�������ﻥΪ�ȵ����壬Ԫ��C������������ķ���ʽ�� ��
��4��Ԫ��E���γɶ��������磺E(CO)5�ȡ�
�ٻ�̬Eԭ�ӵļ۵����Ų�ͼΪ ��
��E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������� ��������ͣ����þ�����E�Ļ��ϼ�Ϊ ��
��5��E��C�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ����Ļ�ѧʽΪ_______�������������Eԭ�Ӽ�ľ���Ϊacm����þ�����ܶ���______g��mL-1��
���𰸡���1��sp2�ӻ���5:1����2��O>N>C>H,NH3������������3��N2O����4��![]() ��
��
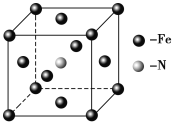
���Ӿ��壬0����5��Fe4N��![]() .
.
��������
���������ԭ���������ε����Ҷ�С��36��A��B��C��D��E����Ԫ�أ�����A��һ�ֺ�����û�����ӣ�A��HԪ�أ�Bԭ�ӻ�̬ʱ���������������ڲ��������2����B��CԪ�أ�Dԭ�ӻ�̬ʱ2pԭ�ӹ������2��δ�ɶԵĵ��ӣ�����B��CԪ�أ�����D��OԪ�أ�C��NԪ�أ�EԪ�ص�ԭ�ӽṹ��3d�ܼ���δ�ɶԵ������dzɶԵ�������2����E��FeԪ�أ���1��C2H4������Cԭ�ӹ�����ӻ�����Ϊsp2�ӻ������ۼ������ǦҼ���˫������һ���Ǧм�����һ���ǦҼ���������ϩ�����ЦҼ��ͦм�������Ϊ5:1����Ϊ��sp2�ӻ���5:1����2����2��A��B��C��D����Ԫ�صĵ縺�ԴӴ�С��˳��ΪO>N>C>H,NH3�д��ڷ��Ӽ�������Էе�Ȼ�����CH4�ĸ�,��Ϊ��O>N>C>H,NH3������������3��N��һ���������C��һ�������ﻥΪ�ȵ����壬��ô�ֱ���N2O��CO2����Ϊ��N2O����4��Ԫ��E��FeԪ�أ��ٻ�̬Eԭ�ӵļ۵����Ų�ͼΪ![]() ����E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������ڷ��Ӿ��壬�þ�����E�Ļ��ϼ�Ϊ0����Ϊ��
����E(CO)5�����³�Һ̬���۵�Ϊ��20.5�����е�Ϊ103���������ڷǼ����ܼ����ݴ˿��ж�E(CO)5�������ڷ��Ӿ��壬�þ�����E�Ļ��ϼ�Ϊ0����Ϊ��![]() �����Ӿ��壬0����5��Fe��N�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ�����Feԭ��λ�ڶ�������ģ������Ϊ8��
�����Ӿ��壬0����5��Fe��N�γɵ�һ�ֻ�����ľ����ṹ��ͼ��ʾ���þ�����Feԭ��λ�ڶ�������ģ������Ϊ8��![]() +6��
+6��![]() =4��Nԭ��λ�����ģ�ԭ�Ӹ���Ϊ1���������Ļ�ѧʽΪFe4N�������������Feԭ�Ӽ�ľ���Ϊacm,����Խ��ߵ�1/2Ϊacm����ô�ⳤΪ
=4��Nԭ��λ�����ģ�ԭ�Ӹ���Ϊ1���������Ļ�ѧʽΪFe4N�������������Feԭ�Ӽ�ľ���Ϊacm,����Խ��ߵ�1/2Ϊacm����ô�ⳤΪ![]() acm����þ�����ܶ���
acm����þ�����ܶ���![]() g��mL-1����Ϊ��Fe4N��
g��mL-1������Fe4N��![]() .
.


 Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д� ���������������Բ��������ϵ�д�
���������������Բ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��д�ṹ��ʽ��
��1�����л����������ijһ��̼ԭ������4����ͬ��ԭ�ӻ���ţ�������̼ԭ�ӳ�Ϊ������̼ԭ�ӡ��� ij����C7H10��ͬ���칹���о��С�����̼ԭ�ӡ�����������H2�����ӳɷ�Ӧ���Ծ��С�����̼ԭ�ӡ�����5�֣����ǵĽṹ��ʽ����
 �����⣬����2�֣��ֱ�Ϊ_____________________��________________________��
�����⣬����2�֣��ֱ�Ϊ_____________________��________________________��
��2��ϩ����CO��H2�ڴ�������������ȩ�ķ�Ӧ��Ϊ�ʻ��ϳɣ�����ϩ�Ʊ�ȩ�ķ�ӦΪCH2=CH2+CO+H2 �� CH3CH2CHO���ɷ���ʽΪC4H8��ϩ�������ʻ��ϳɷ�Ӧʱ���ò��ȩ��������__________�֡�
��3��������A��CH3COOCH2CH3��һ����֧��ͬ���칹�壬̼�����˳ʶԳƽṹ������Cu���������O2��Ӧ�����ܷ���������Ӧ�Ļ�����B��A�Ľṹ��ʽΪ_______________ ��B�Ľṹ��ʽΪ_____________��
��4����ˮż����Ӧ��һ�����͵�ֱ���������Ӧ�����磺
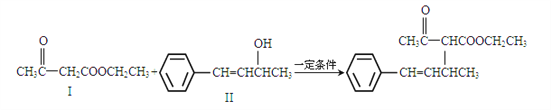
һ�������£�![]() ��
��![]()
Ҳ���Է������Ʒ�Ӧ�ٵķ�Ӧ���л�����Ľṹ��ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ����ȡ���ᴿ���ռ����е��������壨a��b��c��ʾ��Ӧ�����м�����Լ��������п��е��ǣ� ��
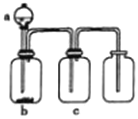
���� | a | b | c | |
A | NO2 | Ũ���� | ͭƬ | NaOH��Һ |
B | SO2 | Ũ�� | Cu | ����KMnO4��Һ |
C | CO2 | ϡ���� | CaCO3 | Ũ���� |
D | NH3 | Ũ��ˮ | ��ʯ�� | ��ʯ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �մɵ���Ҫ�ɷ���̼��� B. ��������뵼��ij��ò���
C. ����Ȼ�����Һ��ȡ������ D. �����۳����Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ư�۵ijɷ���Ҫ��A
A���Ȼ��� B��������� C���Ȼ����������� D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������л����У�A. CH4 B. CH2=CH2 C����D. CH3COOH
��1����ʹ����KMnO4��Һ��ɫ����__________�����ţ���ͬ����
��2��ʵ���ҳ����Ҵ���Ũ�����_________�Ʊ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ԭ���װ�ã������ж���ȷ����
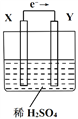
A. ���·�ĵ�������Ϊ��X�����ߡ�Y
B. �����缫���ǽ����������ǵĻ��˳��ΪX��Y
C. X���Ϸ������ǻ�ԭ��Ӧ��Y���Ϸ�������������Ӧ
D. �ŵ�һ��ʱ����ձ�����Һ�����Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ��ˮ��������Ե���
A. NaClB. MgCl2C. NaHCO3D. H2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ǻ���ɫ��״�ᾧ����ṹ��ͼ��ʾ����������ˮ�����ڵ����ᡢ����̼�������л��ܼ����ڷ��ڵ�NaOHϡ��Һ�л�Ѹ��ˮ�⡣�ش���������:

��1��Se��S����һ����ͬ����Ԫ�أ����������Ų�ʽΪ____________��
��2����һ������:S_______ (����>����<������=������ͬ)P���縺�ԣ�S________P��
��3��������������Pԭ�Ӳ�ȡ________�ӻ�����PO3-��Ϊ�ȵ�����Ļ�������ӵĻ�ѧʽΪ______��
��4������̼����__________(���������������Ǽ�����)���ӡ�
��5����NA��ʾ�����ӵ���������ֵ��0.1mol�����������к��еŵ��Ӷ���Ϊ_____��
��6����������(HN3)�ڳ�������һ��Һ�壬�е�ϸߣ�Ϊ308.8K����Ҫԭ����_______��
��7���������ƾ���NaCl�ͽṹ���侧����Na+��OH-֮��ľ���Ϊacm��������Na+����λ��Ϊ__________����NA��ʾ�����ӵ���������ֵ��NaOH���ܶ�Ϊ___________g��cm-3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com