
【题目】三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:

(1)Se是S的下一周期同主族元素,其核外电子排布式为____________;
(2)第一电离能:S_______ (填“>”“<”或“=”,下同)P;电负性:S________P。
(3)三硫化四磷分子中P原子采取________杂化,与PO3-互为等电子体的化合物分子的化学式为______。
(4)二硫化碳属于__________(填“极性”或“非极性”)分子。
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_____。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是_______。
(7)氢氧化钠具有NaCl型结构,其晶饱中Na+与OH-之间的距离为acm,晶胞中Na+的配位数为__________,用NA表示阿伏加德罗常数的数值,NaOH的密度为___________g·cm-3。
【答案】 [Ar]3d104s24p4(或1s22s22p63s23p63d104s24p4) < > sp3 SO3 非极性 NA HN3分子间存在氢键 6 20/(a3NA)
【解析】(1)Se是S的下一周期同主族元素,其核外电子排布式为[Ar]3d104s24p4;
(2)同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于相邻元素;同一主族元素中,元素的第一电离能随着原子序数的增大而减小;同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,第一电离能:S<P;电负性:S>P;
(3)P4S3中P原子成3个P-S键、含有一对孤对电子,杂化轨道数为4,P原子采取sp3杂化;与PO3-互为等电子体的化合物分子的化学式为SO3;
(4)二硫化碳与二氧化碳的结构相似,正负电荷中心重合,属于非极性分子;
(5)根据图知,每个P上1对孤对电子对,每个S有2对孤对电子对,1mol共10对孤对电子对,0.1mol含有NA孤对电子对数;
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是HN3分子间存在氢键,使沸点反常的升高;
(7)以体心Na+研究,与之相邻的Cl-位于面心,晶胞中Na+的配位数为6,晶胞中Na+与Cl-之间的距离为a cm,则晶胞棱长为2a cm,晶胞体积为(2a cm)3,晶胞中Na+离子数目为1+12×![]() =4、Cl-离子数目为8×
=4、Cl-离子数目为8×![]() +6×
+6×![]() =4,则晶胞质量为4×
=4,则晶胞质量为4×![]() g,则晶胞密度为4×
g,则晶胞密度为4×![]() g÷(2a cm)3=
g÷(2a cm)3=![]() g.cm-3。
g.cm-3。


科目:高中化学 来源: 题型:
【题目】原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
(1)B2A4分子中B原子轨道的杂化类型为 ,B2A4分子中σ键和π键个数比为 。
(2)A、B、C、D四种元素的电负性从大到小的顺序为______________(用元素符号表示);化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子式是 。
(4)元素E能形成多种配合物,如:E(CO)5等。
①基态E原子的价电子排布图为 。
②E(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于 (填晶体类型),该晶体中E的化合价为 。
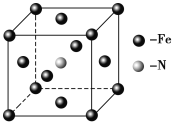
(5)E和C形成的一种化合物的晶胞结构如图所示,该晶胞的化学式为_______。若两个最近的E原子间的距离为acm,则该晶体的密度是______g·mL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一元硬币有银白色的金属光泽,有的同学认为它是由铁制成的,便找磁铁来吸一下,这一过程属于科学探究中的( )
A. 实验 B. 比较 C. 观察 D. 分类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容, 4A(s)+3B(g)![]() 2C(g)+D(g)经2min,B的浓度减少0.6mol·L-1,下列说法正确的是
2C(g)+D(g)经2min,B的浓度减少0.6mol·L-1,下列说法正确的是
A. 用A表示的反应速率是0.4mol·L-1·min-1
B. 分别用B、C表示反应的速率,其关系是:3υ(B)=2υ(C)
C. 2min末的反应速率υ(B)=0.3mol·L-1·min-1
D. 气体的密度不再变化,则证明反应已经达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液:则B极的电极反应式为 , K+移向 极(填A、B)

(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是 。
②B电极上的电极反应式为 ,总反应化学方程式是 。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为 。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的 。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 ,电极反应式是 ,反应一段时间后电解质溶液中Cu2+浓度 (填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别物质或离子的方法能达到目的的是
A. 用氨水鉴别MgCl2溶液和AlCl3溶液
B. 用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
C. 用AgNO3鉴别Na2CO3溶液和NaCl溶液
D. 用足量的盐酸和BaCl2溶液鉴别溶液中是否含SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1的HR溶液中逐渐滴入0.1mol·L-1的NH3·H2O溶液,所得溶液pH及导电能力变化如图。下列分析不正确的是

A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7,此时酸碱恰好中和
C. b、c两点水的电离程度:b<c
D. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德,以下是其中检测出的两种兴奋剂的结构:(注:苯环上的卤原子不易水解,但在一定条件下遇碱液也能缓慢水解)

关于它们的说法中正确的是
A. Y遇到氯化铁溶液时显紫色,并能发生加成、消去、水解等反应
B. 1个Y分子中最多有8个碳原子共面
C. 1molX与足量氢气反应,最多可消耗6molH2
D. 在一定条件下, 1mol X与足量NaOH溶液反应,最多消耗5mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com