
| A. | 失去电子的反应是还原反应 | B. | 发生氧化反应的是氧化剂 | ||
| C. | 作氧化剂的物质不能同时作还原剂 | D. | 失去电子的物质是还原剂 |
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:推断题
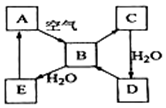 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
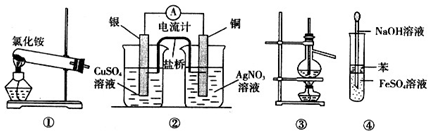
| A. | 实验室用装置①制取氨气 | |
| B. | 装置②将化学能转化为电能 | |
| C. | 装置③可用于分离沸点相差较大的互溶液体混合物 | |
| D. | 装置④可用于 Fe(OH)2的制取,并能防止 Fe(OH)2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 明宋应星《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是CaO | |
| B. | 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是Na2CO3 | |
| C. | 《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐 | |
| D. | 《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下.NH4Cl溶液加水稀释,$\frac{c(N{H}_{3•}{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$增大 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的pH减小 | |
| C. | 室温下稀释O.lmol/LCH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小 | |
| D. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=12的溶液:Cl-、OH-、K+、Ba2+ | |
| B. | 能使酚酞变红的溶液中:SO42-、NH4+、K+、NO3- | |
| C. | 0.1mol/L的Na2CO3溶液中:K+、Ba2+、NO3-、Cl- | |
| D. | 无色透明溶液中:K+、Na+、MnO4-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
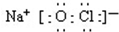 ;若将84消毒液长期露置于空气中,溶液中的主要成分最终将变为NaCl.(填化学式)
;若将84消毒液长期露置于空气中,溶液中的主要成分最终将变为NaCl.(填化学式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com