
分析 ①氯乙烯加成聚合生成聚氯乙烯;
②氨气与二氧化氮发生归中氧化还原反应生成氮气和水,依据氧化还原反应得失电子守恒、原子个数守恒过量书写方程式;
③根据发生的反应分析污水处理方法,反应中有元素化合价升降的反应为氧化还原法,发生复分解反应生成沉淀为沉淀法,N、P元素能引起水体的富营养化.
解答 解:①氯乙烯加成聚合生成聚氯乙烯,所以聚氯乙烯的单体为氯乙烯,结构简式为:CH2=CHCl;
故答案为:CH2=CHCl;
②氨气与二氧化氮发生归中氧化还原反应生成氮气和水,反应方程式:8NH3+6NO2$\frac{\underline{\;催化剂\;}}{△}$7N2+12H2O;
故答案为:8NH3+6NO2$\frac{\underline{\;催化剂\;}}{△}$7N2+12H2O;
③反应中有元素化合价升降的反应为氧化还原法,氨水将Cr3+转变成难溶的Cr(OH)3是利用沉淀法处理污水,所以该方案运用了污水处理方法中的沉淀法和氧化还原法,处理后的废水中因含有大量NH4+会导致水体的富营养化,
故答案为:氧化还原;NH4+.
点评 本题考查知识点较多,为小综合,为高考常见题型,侧重于学生的分析能力和运用知识解决问题能力的考查,明确有机物结构特点、氧化还原反应规律、等知识点是解答关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.
已知某可逆反应mA(g)+nB(g)?qD(g)在密闭容器中进行.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 失去电子的反应是还原反应 | B. | 发生氧化反应的是氧化剂 | ||
| C. | 作氧化剂的物质不能同时作还原剂 | D. | 失去电子的物质是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
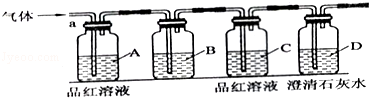
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的氨水中有0.1NA个NH4+ | |
| B. | 标准状况下,22.4L盐酸含有NA个HCI分子 | |
| C. | 常温常压下,14g由N2与CO的混合气体含有0.5NA个原子 | |
| D. | 标准状况下,6.72L N02与水充分反应转移0.2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,氧化产物是K2SO3,氧化剂与还原剂的物质的量之比为2:1,若反应中消耗了0.6molS,则反应中转移的电子为0.8mol.
,氧化产物是K2SO3,氧化剂与还原剂的物质的量之比为2:1,若反应中消耗了0.6molS,则反应中转移的电子为0.8mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com