
【题目】氯酸钾和亚硫酸氢钠起氧化还原反应生成Cl-和SO42-的速率如图所示。关于该反应的叙述错误的( )
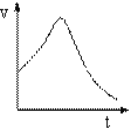
A.氯酸根的氧化性强于硫酸根
B.该反应的速率可能与氢离子浓度有关
C.反应后阶段速率变慢是因为氯酸钾和亚硫酸氢钠浓度越来越小
D.该反应的离子方程式为:ClO3-+3HSO3-+3OH-=3SO42-+Cl-+3H2O
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A ( g)+B(g)![]() 2C(g),若经2 s后测得C的浓度为0.6 mol· L-1,现有下列几种说法,其中正确的是 ( )
2C(g),若经2 s后测得C的浓度为0.6 mol· L-1,现有下列几种说法,其中正确的是 ( )
A.用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.7 mol · L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物与水混合浮在上层
B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④中1 mol苯最多与3 mol H2发生加成反应,因为每个苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下。下列叙述不正确的是
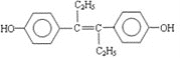
A.M属于芳香族化合物
B.M可与NaOH溶液或NaHCO3溶液发生反应
C.1molM最多能与7molH2发生加成反应
D.1molM与饱和溴水混合,最多消耗5molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用MnO2与浓盐酸反应制备Cl2(反应主要装置如图一所示,其它装置省略)。当盐酸达到一个临界浓度时,反应就会停止。为测定反应残余液中盐酸的临界浓度,探究小组同学提出了下列实验方案:
甲方案:将产生的Cl2与足量AgNO3溶液反应,称量生成的AgCl质量,再进行计算得到余酸的量。
乙方案:采用酸碱中和滴定法测定余酸浓度。
丙方案:余酸与已知量CaCO3(过量)反应后,称量剩余的CaCO3质量。
丁方案:余酸与足量Zn反应,测量生成的H2体积。
具体操作:装配好仪器并检查装置气密性,接下来的操作依次是:
①往烧瓶中加入足量MnO2粉末
②往烧瓶中加入20mL 12molL-1浓盐酸
③加热使之充分反应。
(1)在实验室中,该发生装置除了可以用于制备Cl2,还可以制备下列哪些气体______?
A. O2 B. H2 C. CH2=CH2 D. HCl
若使用甲方案,产生的 Cl2必须先通过盛有 ________(填试剂名称)的洗气瓶, 再通入足量 AgNO3溶液中,这样做的目的是 ______________;已知AgClO易溶于水,写出Cl2与AgNO3溶液反应的化学方程式________________
(2)进行乙方案实验:准确量取残余清液,稀释5倍后作为试样。准确量取试样25.00mL,用1.500mol·L-1NaOH标准溶液滴定,选用合适的指示剂,消耗NaOH标准溶液23.00mL,则由此计算得到盐酸的临界浓度为 ____ mol·L-1(保留两位有效数字);选用的合适指示剂是 _____。
A 石蕊 B 酚酞 C 甲基橙
(3)判断丙方案的实验结果,测得余酸的临界浓度_________ (填偏大、偏小或―影响)。(已知:Ksp(CaCO3)=2.8×10-9、Ksp(MnCO3)=2.3×10-11)
(4)进行丁方案实验:装置如图二所示(夹持器具已略去)。
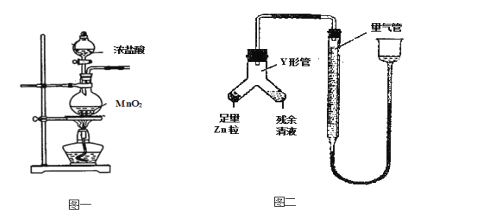
(i)使Y形管中的残余清液与锌粒反应的正确操作是倾斜Y形管,将 _____转移到_____中。
(ii)反应完毕,需要读出量气管中气体的体积,首先要___________,然后再______,最后视线与量气管刻度相平。
(5)综合评价:事实上,反应过程中盐酸浓度减小到临界浓度是由两个方面所致,一是反应消耗盐酸,二是盐酸挥发,以上四种实验方案中,盐酸挥发会对哪种方案带来实验误差(假设每一步实验操作均准确)?____________
A.甲 B.乙 C.丙 D.丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃的结构简式为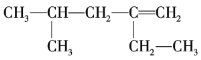 ,甲、乙、丙、丁四位同学分别将其命名为2-甲基-4-乙基-4-戊烯、2-异丁基-1-丁烯、2,4-二甲基-3-己烯、4-甲基-2-乙基-1-戊烯。下列对四位同学的命名判断正确的是( )
,甲、乙、丙、丁四位同学分别将其命名为2-甲基-4-乙基-4-戊烯、2-异丁基-1-丁烯、2,4-二甲基-3-己烯、4-甲基-2-乙基-1-戊烯。下列对四位同学的命名判断正确的是( )
A.甲的命名中对主链的选择是错误的B.乙的命名中对主链碳原子的编号是错误的
C.丙的命名中对主链的选择是正确的D.丁的命名是正确的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃A,其蒸气密度是相同状况下氢气密度的64倍,经测定得知A分子中共含有6个甲基。
(1)若A不是烯烃与氢气加成的产物,则A的结构简式为:__________________________;
(2)若A是炔烃与氢气加成的产物,则A的名称为:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电絮凝的反应原理是以铝、铁等金属为阳极,在直流电的作用下,阳极被溶蚀,产生金属离子,在经一系列水解、聚合及氧化过程,发展成为各种羟基络合物、多核羟基络合物以及氢氧化物,使废水中的胶态杂质、悬浮杂质凝聚沉淀而分离。下列说法不正确的是
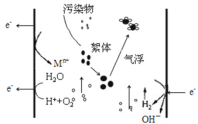
A.每产生1molO2,整个电解池中理论上转移电子数为4NA
B.阴极电极反应式为2H2O + 2e- = H2↑+2OH—
C.若铁为阳极,则阳极电极方程式为Fe-2e-=Fe2+和2H2O - 4e- = O2↑+4H+
D.若铁为阳极,则在处理废水的过程中阳极附近会发生:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com