
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式:____________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图Ⅰ所示。
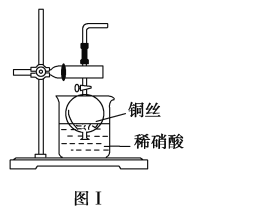
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝 C.银 D.玻璃 E.聚丙烯塑料
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是_________(填化学方程式)
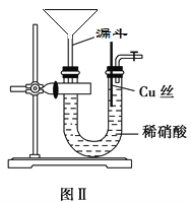
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某同学另设计了一套如图Ⅱ所示制取NO的装置。反应开始后,可以在U形管右端观察到无色的NO气体。
①漏斗的作用是_____________________________________________________。
②让反应停止的操作方法及原因是________________________________________。
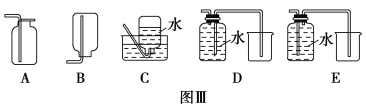
(4)以下收集NO气体的装置(见图Ⅲ),合理的是________(填选项代号)。
【答案】(1)3Cu+8H++2NO3-===3Cu2++4H2O+2NO↑ (2)①D、E ②2NO+O2===2NO2
(3)①接收被气体压出U形管的液体,防止稀硝酸溢出
②关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端管内的稀硝酸向下压,使铜丝与稀硝酸分开,反应停止 (4)C、D
【解析】
试题分析:Ⅰ.(1)金属铜可以和稀硝酸发生氧化还原反应生成硝酸铜、一氧化氮以及水,反应的离子方程式为3Cu+8H++2NO3-===3Cu2++4H2O+2NO↑。
(2)①实验室若没有铜丝,铜粒以代替铜丝进行实验,则包裹桶里的不能是金属铁以及金属铝,因为他们的活泼性强于金属铜,会先于金属铜和硝酸之间发生反应,另外银也能溶解在硝酸中,因此答案选D、E。
②试管内有空气,NO容易被氧化为红棕色的气体二氧化氮,即2NO+O2═2NO2。
(3)①一氧化氮是难溶于水的气体,当制取一氧化氮的装置产生一氧化氮气体时,气体难溶于水,气体把U形管的液体压出,所以长玻璃管的作用是:接收被气体压出U形管的液体,防止稀硝酸溢出。
②让反应停止的操作方法及原因是:关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止。
(4)NO能与O2反应,不能用排空气法收集,NO难溶于水,可用排水法收集,故C、D正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 | C的质 | A上有气 |
根据实验现象回答下列问题:
①装置甲中作正极的是________ (填“A”或“B”) 。
②装置乙溶液中Cu2+向_______极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于______(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2:化学与技术】高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“![]() 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③“电解法”和“![]() 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A~I九种物质之间的转化关系如图所示,其中部分生成物或反应条件已略去。已知A在常温下为黑色固体单质,常温下C、E、F都是无色气体。

请回答下列问题:
(1)C的固体名称________,F的化学式是________。
(2) B的浓溶液与A反应过程中,B体现的性质与下列反应中HNO3体现的性质完全相同的是_____。
A.C+4HNO3(浓)![]() CO2+4NO2↑+2H2O
CO2+4NO2↑+2H2O
B.3Fe+8HNO3(稀 )=3Fe(NO3 )2+2NO↑+4H2O
C.Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
D.2Fe2O3+6HNO3===2Fe(NO3)3+3H2O
(3)A与B反应的化学方程式是____________。
(4)G与H反应的离子方程式是_________________________;
C与淡黄色固体反应生成F与G的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中HNO3既表现出酸性又表现出强氧化性的是
A.稀硝酸与CuO反应
B.稀硝酸与NaOH 溶液反应
C.浓硝酸与灼热的碳反应
D.浓硝酸与铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.11.2 L CO2所含分子数为0.5 NA
B.1 L 0.1 molL﹣1的Na2S溶液中离子数为0.3 NA
C.0.5 mol FeBr2与足量氯气反应转移的电子数为NA
D.14.2 g Na2SO4固体中阴离子所带电荷数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。该转化关系中A 可能是下列物质中的( )
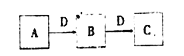
①金属钠 ②硫单质 ③NH3④Na2C03⑤AlCl3溶液 ⑥单质铁
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:
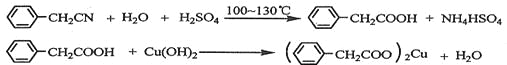
制备苯乙酸的装置示意图如下(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
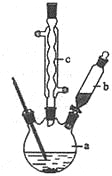
(1)在250mL三口瓶a中加入70mL70%硫酸,并向三口烧瓶中放入少量______,其作用是_______。
(2)将a中的溶液加热至100℃,缓缓滴加20g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。用仪器b缓缓滴加苯乙腈的原因是 _________ ;仪器c的名称是 。反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是 。分离苯乙酸粗品操作中用到的玻璃仪器除烧杯外还有_________ 。
(3)提纯粗苯乙酸后最终得到21g纯品,则苯乙酸的产率是 。(保留两位有效数字)
(4)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com