
【题目】下列反应中HNO3既表现出酸性又表现出强氧化性的是
A.稀硝酸与CuO反应
B.稀硝酸与NaOH 溶液反应
C.浓硝酸与灼热的碳反应
D.浓硝酸与铜反应
科目:高中化学 来源: 题型:
【题目】3月调研)[化学——选修3:物质结构与性质]氮化硼( BN)是一种重要的功能陶瓷材料。以天然硼砂(主要成分Na2B4O7)为起始物,经过一系列反应可以得到BN和火箭高能燃料及有机合成催化剂BF3的过程如下:

(1)写出由B203制备BF3的化学方程式 ,BF3中B原子的杂化轨道类型为____,BF3分子空间构型为____。
(2)在硼、氧、氟、氮中第一电离能由大到小的顺序是(用元素符号表示)____。
(3)已知:硼酸的电离方程式为H3B03 +H20 ![]() [B(OH)4] - +H+,试依据上述反应写出[ Al( OH)4] -的结构式____,并推测1mol NH4BF4(氟硼酸铵)中含有____个配位键。
[B(OH)4] - +H+,试依据上述反应写出[ Al( OH)4] -的结构式____,并推测1mol NH4BF4(氟硼酸铵)中含有____个配位键。
(4)由12个硼原子构成如图1的结构单元,硼晶体的熔点为1873℃,则硼晶体的1个结构单元中含有____ 个B-B键。

(5)氮化硼(BN)晶体有多种相结构。六方相氮化硼(晶体结构如图2)是通常存在的稳定相可作高温润滑剂。立方相氮化硼(晶体结构如图3)是超硬材料,有优异的耐磨性。
①关于这两种晶体的说法,不正确的是____(填字母)。
a.两种晶体均为分子晶体
b.两种晶体中的B-N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体内B-N键数与硼原子数之比为__ __,其结构与石墨相似却不导电,原因是____。
③立方相氮化硼晶体中,每个硼原子连接____个六元环。该晶体的天然矿物在青藏高原地下约300 km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:

(1)写出A中反应的化学方程式__________________________________________。
(2)试管C中苯的作用是:________________。反应开始后,观察D和E两试管,看到的现象为:D________________;E________________。
(3)B中的NaOH溶液的作用是_____________________________________________,可观察到的现象是________________。
(4)在上述整套装置中,具有防倒吸的装置有________(填字母序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。
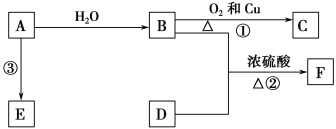
(1)A的结构式为____________,B中决定其性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①______________________________________,反应类型:____________。
③________________________,反应类型:____________。
(3)实验室怎样鉴别B和D?_________________________________________________。
(4)该装置图中有一个明显的错误是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。

(1)元素R在周期表中的位置是 。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为 。
(3)测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为 。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
A.相同条件下水溶液的PH:Na2CO3>Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为: 。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则A的化学式为 ;若气体a为单质,反应 II的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式:____________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图Ⅰ所示。
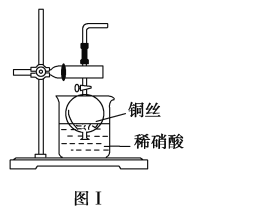
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这丝状材料的成分可以是________(填选项编号)。
A.铁 B.铝 C.银 D.玻璃 E.聚丙烯塑料
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是_________(填化学方程式)
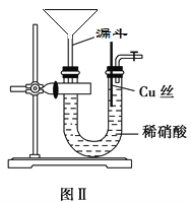
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某同学另设计了一套如图Ⅱ所示制取NO的装置。反应开始后,可以在U形管右端观察到无色的NO气体。
①漏斗的作用是_____________________________________________________。
②让反应停止的操作方法及原因是________________________________________。
(4)以下收集NO气体的装置(见图Ⅲ),合理的是________(填选项代号)。
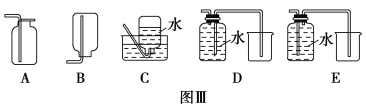
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是
A.X离子的氧化性比Y离子氧化性强
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于氨水
D. W单质的氧化性比Z单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2:化学与技术】
炼锌厂产生的工业废渣—锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:

已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。
试回答下列问题:
(1)“浸出”时用到的“试剂X”为___________(填名称)。
(2)写出“氧化”过程的离子方程式____________。
(3)“调pH”过程可以选用_____________。(从以下选项选择,填序号)
A.H2SO4 B.ZnO C.NaOH D.ZnCO3
“滤渣2”的主要成分是___________(填化学式,下同)。
(4)“试剂Y”是_______________;写出除去Cd2+的化学方程式_______________。
(5)“操作1”的方法是_______________;在“操作1”时,必须采取的实验措施是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:

已知:HCl的沸点是﹣85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是______________。反应设备不能用玻璃材质的原因是______________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的___________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:_______________________________。
(3)第④步分离采用的方法是_________;第⑤步分离尾气中HF、HCl采用的方法是______。
(4)LiPF6产品中通常混有少量LiF。取样品wg,测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为______mol(用含w、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com