
【题目】已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。
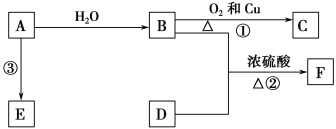
(1)A的结构式为____________,B中决定其性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①______________________________________,反应类型:____________。
③________________________,反应类型:____________。
(3)实验室怎样鉴别B和D?_________________________________________________。
(4)该装置图中有一个明显的错误是_______________________________________________。
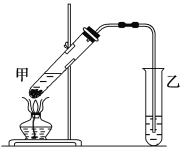
【答案】(1) 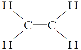 ,羟基;(2)①2CH3CH2OH+O22CH3CHO+2H2O,氧化反应;③
,羟基;(2)①2CH3CH2OH+O22CH3CHO+2H2O,氧化反应;③![]() ,加聚反应;(3)取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇(或其他合理方法);(4)导气管的出口伸入到了液面以下。
,加聚反应;(3)取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇(或其他合理方法);(4)导气管的出口伸入到了液面以下。
【解析】
试题分析:A为衡量石油化工发展的标志,即A为乙烯,乙烯和H2O在一定条件下发生加成反应,生成乙醇,乙醇催化氧化成生成C,C为乙醛,D是饮食中常见的有机物,且F为具有香味,则D为乙酸,F为乙酸乙酯,A形成高分子化合物,乙烯通过加聚反应生成聚乙烯,(1)乙烯结构式为: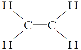 ,乙醇的官能团是羟基;(2)反应①是乙醇的催化氧化,反应方程式为:2CH3CH2OH+O22CH3CHO+2H2O,属于氧化反应,反应③是乙烯的加聚反应,其反应方程式为:
,乙醇的官能团是羟基;(2)反应①是乙醇的催化氧化,反应方程式为:2CH3CH2OH+O22CH3CHO+2H2O,属于氧化反应,反应③是乙烯的加聚反应,其反应方程式为:![]() ;(3)检验乙酸,利用乙酸具有酸性,能使石蕊变红,或者加入碳酸盐,产生气泡,则另一种为乙醇;(4)防止倒吸,试管中的导管不能深入液面以下。
;(3)检验乙酸,利用乙酸具有酸性,能使石蕊变红,或者加入碳酸盐,产生气泡,则另一种为乙醇;(4)防止倒吸,试管中的导管不能深入液面以下。


科目:高中化学 来源: 题型:
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)试写出SiCl4的电子式_____________________________。
(2)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的物质的量增加了0.02mol,则H2的平均反应速率为____________________。
(3)上述反应达到平衡后,下列说法正确的是__________。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4的物质的量平衡向左移动
d.其他条件不变,增大HCl的浓度平衡向左移动
(4)一定条件下,在恒容密闭的容器中,能表示上述反应达到化学平衡状态的是_____。
a.3v逆(N2)= v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
e.单位时间内有n molN2消耗的同时有6 molHCl生成
(5)若平衡时H2和HCl的物质的量之比为m:n,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比_______m:n(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2:化学与技术】高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:

回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“![]() 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③“电解法”和“![]() 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修2:化学与技术] 化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCI2副产品,该工艺中生成CaCI2的化学反应方程式为__
②“联合制碱法”中相关的化学反应方程式为
③CO2是制碱工业的重要原料,请阐述“联合制碱法”与“氨碱法”中C02的来源有何不同 。
(2)铀(U)是核反应最重要的燃料,在核反应中有重要的应用。目前已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素,其反应原理为___ _(用离子方程式表示,树脂用HR代替,下同),发生离子交换后的离子交换膜用酸处理还可再生,并得到含铀的溶液,其反应原理为 。
(3)钢铁工业对促进经济和社会发展起了重要作用。
①不锈钢中含有的铬元素是在炼钢过程的氧吹 (填“前”或“后”)加入。
②炼钢时,加入硅、锰和铝的目的是____ 。
③炼铁和炼钢生产中,尾气均含有的主要污染物是____ ;从环保和经济角度考虑,上述尾气经处理可用作____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列A~I九种物质之间的转化关系如图所示,其中部分生成物或反应条件已略去。已知A在常温下为黑色固体单质,常温下C、E、F都是无色气体。

请回答下列问题:
(1)C的固体名称________,F的化学式是________。
(2) B的浓溶液与A反应过程中,B体现的性质与下列反应中HNO3体现的性质完全相同的是_____。
A.C+4HNO3(浓)![]() CO2+4NO2↑+2H2O
CO2+4NO2↑+2H2O
B.3Fe+8HNO3(稀 )=3Fe(NO3 )2+2NO↑+4H2O
C.Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
D.2Fe2O3+6HNO3===2Fe(NO3)3+3H2O
(3)A与B反应的化学方程式是____________。
(4)G与H反应的离子方程式是_________________________;
C与淡黄色固体反应生成F与G的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中HNO3既表现出酸性又表现出强氧化性的是
A.稀硝酸与CuO反应
B.稀硝酸与NaOH 溶液反应
C.浓硝酸与灼热的碳反应
D.浓硝酸与铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。该转化关系中A 可能是下列物质中的( )
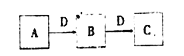
①金属钠 ②硫单质 ③NH3④Na2C03⑤AlCl3溶液 ⑥单质铁
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.CO2和H2S B.SO2和SiO2 C.NH4Cl和HCl D.CCl4和KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com