
【题目】[化学一选修2:化学与技术] 化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCI2副产品,该工艺中生成CaCI2的化学反应方程式为__
②“联合制碱法”中相关的化学反应方程式为
③CO2是制碱工业的重要原料,请阐述“联合制碱法”与“氨碱法”中C02的来源有何不同 。
(2)铀(U)是核反应最重要的燃料,在核反应中有重要的应用。目前已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素,其反应原理为___ _(用离子方程式表示,树脂用HR代替,下同),发生离子交换后的离子交换膜用酸处理还可再生,并得到含铀的溶液,其反应原理为 。
(3)钢铁工业对促进经济和社会发展起了重要作用。
①不锈钢中含有的铬元素是在炼钢过程的氧吹 (填“前”或“后”)加入。
②炼钢时,加入硅、锰和铝的目的是____ 。
③炼铁和炼钢生产中,尾气均含有的主要污染物是____ ;从环保和经济角度考虑,上述尾气经处理可用作____ 。
【答案】(1)①2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O(2分)②NH3+CO2+H2O+NaCl(饱和)===NaHCO3↓+NH4Cl(2分) 2NaHCO3
2NH3↑+CaCl2+2H2O(2分)②NH3+CO2+H2O+NaCl(饱和)===NaHCO3↓+NH4Cl(2分) 2NaHCO3![]() Na2CO3+CO2↑+H2O(2分)③ “氨碱法”CO2来源于石灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气(1分)
Na2CO3+CO2↑+H2O(2分)③ “氨碱法”CO2来源于石灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气(1分)
(2)4HR+U4+===UR4+4H+(2分) UR4+4H+===4HR+U4+(2分)
(3)① 后(1分) ② 脱氧和调整钢的成分(1分) ③ CO ;燃料(或还原剂) (2分,各1分)
【解析】
试题分析:(1)①氨碱法生成CaCI2的化学反应方程式为2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O;②联合制碱法中相关的化学反应方程式为NH3+CO2+H2O+NaCl(饱和)===NaHCO3↓+NH4Cl;③“氨碱法”CO2来源于石灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气。
2NH3↑+CaCl2+2H2O;②联合制碱法中相关的化学反应方程式为NH3+CO2+H2O+NaCl(饱和)===NaHCO3↓+NH4Cl;③“氨碱法”CO2来源于石灰石煅烧,“联合制碱法”CO2来源于合成氨工业的废气。
(2)吸附之后与酸反应又能还原回来故对应反应为:4HR+U4+===UR4+4H+;UR4+4H+===4HR+U4+。
(3)①因为Cr易被氧化,为Cr被氧化,不锈钢含有的Cr元素是在炼钢过程的氧吹后,若氧吹前加入Cr会形成炉渣被除去;②炼钢时,加入硅、锰和铝,可与氧气反应,且能改变合金的性质,起到脱氧和调整钢的成分的作用;炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有的主要污染物是CO,一氧化碳会引起中毒,故需对其进行尾气处理.一氧化碳是一种很好的还原剂同时还是一种燃料。


科目:高中化学 来源: 题型:
【题目】[物质结构与性质]
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN

(1)Zn2+基态核外电子排布式为____________________。
(2)1 mol HCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
(5)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用足量的一氧化碳还原14.5g铁的氧化物的混合物。将生成的气体通入足量的澄清石灰水中,生成沉淀25g,则该混合物的组合可能的是
A.Fe2O3、Fe3O4、FeO
B.FeO、Fe3O4
C.Fe3O4、Fe2O3
D.Fe3O4、Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
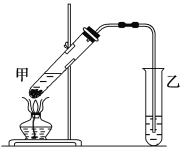
【题目】苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:

(1)写出A中反应的化学方程式__________________________________________。
(2)试管C中苯的作用是:________________。反应开始后,观察D和E两试管,看到的现象为:D________________;E________________。
(3)B中的NaOH溶液的作用是_____________________________________________,可观察到的现象是________________。
(4)在上述整套装置中,具有防倒吸的装置有________(填字母序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅是人类文明发展的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)工业生产粗硅的反应有:SiO2+2C![]() Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C![]() SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
(2)工业上可以通过如下图所示的流程制取纯硅:
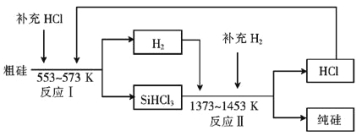
①若反应I为 Si(粗)+3HCl![]() SiHCl3+H2,则反应II的化学方程式为 。
SiHCl3+H2,则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。
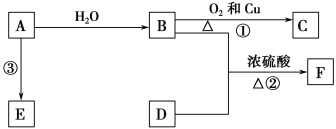
(1)A的结构式为____________,B中决定其性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①______________________________________,反应类型:____________。
③________________________,反应类型:____________。
(3)实验室怎样鉴别B和D?_________________________________________________。
(4)该装置图中有一个明显的错误是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。

(1)元素R在周期表中的位置是 。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为 。
(3)测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为 。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
A.相同条件下水溶液的PH:Na2CO3>Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为: 。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则A的化学式为 ;若气体a为单质,反应 II的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是
A.X离子的氧化性比Y离子氧化性强
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于氨水
D. W单质的氧化性比Z单质强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。 如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是( )

A.腐蚀过程中,负极是c
B.正极反应是O2 + 4e-+2H2O=4OH-
C.若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况)
D.环境中的Cl扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com