
【题目】[物质结构与性质]
[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN

(1)Zn2+基态核外电子排布式为____________________。
(2)1 mol HCHO分子中含有σ键的数目为____________mol。
(3)HOCH2CN分子中碳原子轨道的杂化类型是______________。
(4)与H2O分子互为等电子体的阴离子为________________。
(5)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_____________。
【答案】(1)1s22s22p62s23p63d10(或[Ar] 3d10)(2)3;(3)sp3和sp;(4)NH2-;
(5) ;
;
【解析】
试题分析:(1)Zn是30号元素,Zn2+核外有28个电子,根据原子核外电子排布规律可知基态Zn2+核外电子排布式为1s22s22p62s23p63d10;
(2)甲醛的结构式是![]() ,由于单键都是σ键,双键中有一个σ键和一个π键,因此在一个甲醛分子中含有3个σ键和1个π键,所以在1 mol HCHO分子中含有σ键的数目为3 mol;
,由于单键都是σ键,双键中有一个σ键和一个π键,因此在一个甲醛分子中含有3个σ键和1个π键,所以在1 mol HCHO分子中含有σ键的数目为3 mol;
(3)根据HOCH2CN的结构简式可知在HOCH2CN分子中,连有羟基-OH的碳原子形成4个单键,因此杂化类型是sp3杂化,含有—CN的碳原子与N原子形成三键,则取轨道的杂化轨道类型是sp杂化;
(4)原子数和价电子数分别都相等的是等电子体,H2O含有10个电子,则与H2O分子互为等电子体的阴离子为NH2-;
(5)在[Zn(CN)4]2-中Zn2+与CN-的N原子形成配位键,N原子提供一对孤对电子,Zn2+的空轨道接受电子对,因此若不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为 。
。


科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,式量248) 可用于照相行业的定影剂。它易溶于水,且溶解度随温度升高而显著增大,难溶于乙醇,加热时易分解,实验室模拟工业制备硫代硫酸钠晶体通常有两种方法。(硫单质不溶于水,微溶于酒精)
I 亚硫酸钠法:Na2SO3+S+5H2O=Na2S2O3·5H2O,简易实验流程如下:

(1)硫粉用乙醇润湿的目的是 ;
(2)洗涤粗产品,下列洗涤剂最合适的是 ;
A.冰水 B.热水 C.乙醇 D.乙醇-水混合溶液
(3)所得粗产品一般通过 方法提纯;
II硫化碱法:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,主要实验装置如下:
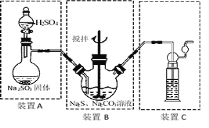
(4)装置C中可放入 ;
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(5)为测定粗产品中Na2S2O35H2O的纯度。某兴趣小组称取5.0 g粗产品配成250mL溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.01mol/L KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时到达滴定终点。实验数据如下表:
滴定次数 | 1 | 2 | 3 |
消耗Na2S2O3溶液(mL) | 19.98 | 21.18 | 20.02 |
该产品的纯度是 ;
(6)硫代硫酸钠产率受温度、pH影响如下图:

下列说法不正确的是 。
A.生成Na2S2O3一定是放热反应
B. 制备应采取较低温度
C.Na2S2O3一定能和0.1mol·L-1的硫酸发生反应
D.控制pH和温度,可以提高Na2S2O3的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L。下列判断正确的是( )
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L。下列判断正确的是( )
A. x =1
B. A的平均反应速率为0.3mol/(L·s)
C. B的转化率为60%
D. 若混合气体的密度不再改变时,该反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1 和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000molL﹣1盐酸滴入20.00mL 1.000molL﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是:

A.a点由水电离出的c(H+)=1.0×10﹣14molL﹣1
B.b点:c(NH4+)+c(NH3H2O)=c(Cl﹣)
C.c点:c(Cl﹣)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)试写出SiCl4的电子式_____________________________。
(2)在一定温度下进行上述反应,若反应容器的容积为2 L,3 min后达到平衡,测得固体的物质的量增加了0.02mol,则H2的平均反应速率为____________________。
(3)上述反应达到平衡后,下列说法正确的是__________。
a.其他条件不变,压强增大,平衡常数K减小
b.其他条件不变,温度升高,平衡常数K减小
c.其他条件不变,增大Si3N4的物质的量平衡向左移动
d.其他条件不变,增大HCl的浓度平衡向左移动
(4)一定条件下,在恒容密闭的容器中,能表示上述反应达到化学平衡状态的是_____。
a.3v逆(N2)= v正(H2)
b.v正(HCl)=4v正(SiCl4)
c.混合气体密度保持不变
d.c(N2):c(H2):c(HCl)=1:3:6
e.单位时间内有n molN2消耗的同时有6 molHCl生成
(5)若平衡时H2和HCl的物质的量之比为m:n,保持其它条件不变,降低温度后达到新的平衡时,H2和HCl的物质的量之比_______m:n(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含原子数一定相等的是( )
A. 同质量、不同密度的N2和CO2 B. 同温度、同体积的H2和N2
C. 同体积、同密度的C2H4和C3H6 D. 同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D、E之间发生如下的转化:

(1)写出D分子中官能团的名称: ,C物质的结构简式: 。
(2)上述①~⑧转化反应中,属于取代反应的有 ;
属于加成反应的有 。(用反应序号填写)
(3)向A的水溶液中加入新制的Cu(OH)2并加热时产生的实验现象是 。
(4)请写出下列转化的化学反应方程式:
①(C6H10O5)n→A: ;
②B+D→E : ;
③乙烯生成聚乙烯: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修2:化学与技术] 化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCI2副产品,该工艺中生成CaCI2的化学反应方程式为__
②“联合制碱法”中相关的化学反应方程式为
③CO2是制碱工业的重要原料,请阐述“联合制碱法”与“氨碱法”中C02的来源有何不同 。
(2)铀(U)是核反应最重要的燃料,在核反应中有重要的应用。目前已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素,其反应原理为___ _(用离子方程式表示,树脂用HR代替,下同),发生离子交换后的离子交换膜用酸处理还可再生,并得到含铀的溶液,其反应原理为 。
(3)钢铁工业对促进经济和社会发展起了重要作用。
①不锈钢中含有的铬元素是在炼钢过程的氧吹 (填“前”或“后”)加入。
②炼钢时,加入硅、锰和铝的目的是____ 。
③炼铁和炼钢生产中,尾气均含有的主要污染物是____ ;从环保和经济角度考虑,上述尾气经处理可用作____ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com