
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
下列叙述正确的是
A.X离子的氧化性比Y离子氧化性强
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于氨水
D. W单质的氧化性比Z单质强
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】有机物A、B、C、D、E之间发生如下的转化:

(1)写出D分子中官能团的名称: ,C物质的结构简式: 。
(2)上述①~⑧转化反应中,属于取代反应的有 ;
属于加成反应的有 。(用反应序号填写)
(3)向A的水溶液中加入新制的Cu(OH)2并加热时产生的实验现象是 。
(4)请写出下列转化的化学反应方程式:
①(C6H10O5)n→A: ;
②B+D→E : ;
③乙烯生成聚乙烯: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修2:化学与技术] 化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCI2副产品,该工艺中生成CaCI2的化学反应方程式为__
②“联合制碱法”中相关的化学反应方程式为
③CO2是制碱工业的重要原料,请阐述“联合制碱法”与“氨碱法”中C02的来源有何不同 。
(2)铀(U)是核反应最重要的燃料,在核反应中有重要的应用。目前已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素,其反应原理为___ _(用离子方程式表示,树脂用HR代替,下同),发生离子交换后的离子交换膜用酸处理还可再生,并得到含铀的溶液,其反应原理为 。
(3)钢铁工业对促进经济和社会发展起了重要作用。
①不锈钢中含有的铬元素是在炼钢过程的氧吹 (填“前”或“后”)加入。
②炼钢时,加入硅、锰和铝的目的是____ 。
③炼铁和炼钢生产中,尾气均含有的主要污染物是____ ;从环保和经济角度考虑,上述尾气经处理可用作____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中HNO3既表现出酸性又表现出强氧化性的是
A.稀硝酸与CuO反应
B.稀硝酸与NaOH 溶液反应
C.浓硝酸与灼热的碳反应
D.浓硝酸与铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:


查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如右图是所示。
(1)右图中的线2表示的组分为 (填化学式)。
(2)实验时,“反应II”中加入NaOH溶液的目的是 (用化学方程式表示)。
(3)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了两种方法进行测定。
①方法I:称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)
②方法II:称取1.326g产品,配成100mL溶液,取25.00mL该溶液,滴加0.1250mol/L I2溶液,恰好使Na2SO3完全氧化生成Na2SO4时,消耗I2溶液20.00mL。通过计算确定产品中Na2SO3的质量分数(写出计算过程)
③判断Na2SO3产品的等级,并说明理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。该转化关系中A 可能是下列物质中的( )
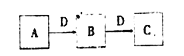
①金属钠 ②硫单质 ③NH3④Na2C03⑤AlCl3溶液 ⑥单质铁
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列字母分别代表某一化学元素。

(1)下列 (填写编号)组元素的单质具有良好导电性。
①a、c、m ②b、g、k ③c、h、1 ④d、e、f
(2)电离能主要取决于原子核对核外电子的吸引力和形成稳定结构的倾向。下表是一些气态原子各级电离能的数据(kJ·mol-1):
锂 | X | Y | |
失去一个电子 | 519 | 502 | 580 |
失去二个电子 | 7296 | 4570 | 1820 |
失去三个电子 | 11799 | 6920 | 2750 |
失去四个电子 | 9550 | 11600 |
①为什么锂原子的第二电离能远远大于第一电离能 。
②用电子式表示X和j以原子个数1比1形成的一种化合物 。
③Y在周期表中是 族元素。
④e元素的电子排布式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制备三氯化铬的流程如图所示:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净? 。
(2)已知CCl4沸点为76.8℃,为保证稳定的CCl4气流,适宜的加热方式是。
(3)用如图装置制备CrCl3时,反应管中发生的主要反应为:Cr2O3+3CCl4![]() 2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用:① ;② 。
2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用:① ;② 。

(4)Cr对环境会造成严重的污染,废水中的Cr3+可用石灰乳进行沉降,写出沉降的离子方程式________________________。
(5)样品中三氯化铬质量分数的测定:称取样品0.3000g,加水溶解并定容于250mL
容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加入1g Na2O2,充分加热煮沸,适当稀释,然后加入过量2mol·L–1H2SO4至溶液呈强酸性,此时铬以![]() 存在,再加入1.1g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5min后,加入0.5mL指示剂,用0.0250mol·L–1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL。(已知:2Na2S2O3+I2
存在,再加入1.1g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5min后,加入0.5mL指示剂,用0.0250mol·L–1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL。(已知:2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
①滴定实验可选用的指示剂名称为,判定终点的现象是;若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使样品中无水三氯化铬的质量分数的测量结果(填“偏高”“偏低”或“无影响”)。
②加入Na2O2后要加热煮沸,其主要原因是,如果没有加热煮沸,则会使样品中无水三氯化铬的质量分数的测量结果(填“偏高”“偏低”或“无影响”)。
③加入KI时发生反应的离子方程式为。
④样品中无水三氯化铬的质量分数为(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于吸热反应的是( )。
A. 铝片与稀盐酸的反应
B. Ba(OH)2·8H2O和NH4Cl的反应
C. 灼热的炭与CO2的反应
D. 甲烷在氧气中的燃烧反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com