
【题目】硅是人类文明发展的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)工业生产粗硅的反应有:SiO2+2C![]() Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C![]() SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
(2)工业上可以通过如下图所示的流程制取纯硅:
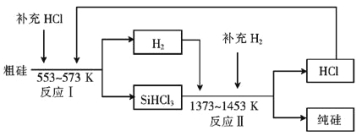
①若反应I为 Si(粗)+3HCl![]() SiHCl3+H2,则反应II的化学方程式为 。
SiHCl3+H2,则反应II的化学方程式为 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式: 。
③设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是 。
【答案】(1)1:2(2)①SiHCl3+H2![]() Si(纯)+3HCl
Si(纯)+3HCl
②SiHCl3+3H2O=H2SiO3+3HCl+H2↑ ③5:1
【解析】
试题分析:(1)将两方程式叠加,可知C和SiO2的物质的量之比为5:2,因此质量比为:(5×12):(2×60)=1:2。
(2)①由流程图可知反应II是SiHCl3和H2反应生成纯硅和HCl,因此方程式为SiHCl3+H2![]() Si(纯)+3HCl。
Si(纯)+3HCl。
②写出方程式中已知物质:SiHCl3+3H2O — H2SiO3+3HCl,由原子守恒可知另一种物质为H2,因此反应的化学方程式为SiHCl3+3H2O=H2SiO3+3HCl+H2↑。
③由题中条件可知:
Si(粗)+ 3HCl ![]() SiHCl3 + H2
SiHCl3 + H2
1mol 3mol 1mol
SiHCl3+H2 ![]() Si(纯)+3HCl
Si(纯)+3HCl
1mol 1mol 3mol
由以上数据可知循环生产中只能产生3molHCl,但HCl的利用率是90%,因此需要增加(![]() )molHCl,循环生产中只产生1molH2,但H2的利用率为93.75%,因此需增加(
)molHCl,循环生产中只产生1molH2,但H2的利用率为93.75%,因此需增加(![]() )molH2,所以补充投入HCl 和H2的物质的量之比为:(
)molH2,所以补充投入HCl 和H2的物质的量之比为:(![]() ):(
):(![]() )=5:1。
)=5:1。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】室温下,将1.000molL﹣1盐酸滴入20.00mL 1.000molL﹣1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是:

A.a点由水电离出的c(H+)=1.0×10﹣14molL﹣1
B.b点:c(NH4+)+c(NH3H2O)=c(Cl﹣)
C.c点:c(Cl﹣)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁合金已成为飞机制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
【方案一】(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0mol/L NaOH溶液中,使其反应完全,过滤、洗涤、干燥、称量固体。实验中发生反应的化学方程式是__________.该步骤中若未洗涤固体,测得镁的质量分数将______(填“偏高”、“偏低”或“无影响”)。
【方案二】
将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积.
(1)同学们拟选用下列实验装置完成实验如图1:
①你认为最简易的装置其连接顺序是:A接______接______接______(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因______.
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是______。
A、待实验装置冷却后再读数
B、上下移动量筒F,使其中液面与广口瓶中液面相平
C、上下移动量筒G,使其中液面与广口瓶中液面相平
D、视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了图2所示的实验装置。
①装置中导管a的作用是______。
②怎样检查图2装置的气密性____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铝粉与Fe3O4粉末配制成铝热剂,分成三等份。
①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;
②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V2;
③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3。
下列说法正确的是( )
A. V1=V3>V2 B. V2>V1=V3 C. V1=V2>V3 D. V1>V3>V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.垃圾资源化的主要途径是卫生填埋
B.人类的活动不影响氮、硫元素在自然界的循环
C.推广使用新能源,可以减少二氧化碳等温室气体的排放
D.在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修2:化学与技术] 化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。
①“氨碱法”产生大量CaCI2副产品,该工艺中生成CaCI2的化学反应方程式为__
②“联合制碱法”中相关的化学反应方程式为
③CO2是制碱工业的重要原料,请阐述“联合制碱法”与“氨碱法”中C02的来源有何不同 。
(2)铀(U)是核反应最重要的燃料,在核反应中有重要的应用。目前已经研制成功一种螫合型离子交换树脂,它专门吸附海水中的U4+,而不吸附其他元素,其反应原理为___ _(用离子方程式表示,树脂用HR代替,下同),发生离子交换后的离子交换膜用酸处理还可再生,并得到含铀的溶液,其反应原理为 。
(3)钢铁工业对促进经济和社会发展起了重要作用。
①不锈钢中含有的铬元素是在炼钢过程的氧吹 (填“前”或“后”)加入。
②炼钢时,加入硅、锰和铝的目的是____ 。
③炼铁和炼钢生产中,尾气均含有的主要污染物是____ ;从环保和经济角度考虑,上述尾气经处理可用作____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量二价铁和三价铁的氧化物及硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
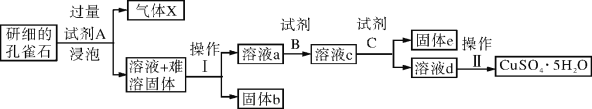
(1)试剂A的化学式是_____________;操作Ⅰ的名称是______________;
(2)生成气体X的化学方程式为:_________________________________。
(3)使用试剂B的目的是将溶液中的Fe2+转化为Fe3+,试剂B最好选用_________
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)已知:
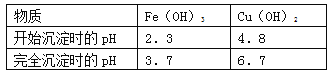
①试剂C的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离。试剂C宜选用__________:
A.稀硫酸 B.NaOH溶液 C.氨水 D.CuO
②为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为__________。
(5)请设计一种实验方案检验溶液中Fe3+是否完全除去(写出操作步骤、现象和结论) ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:


查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中,溶液中有关组分的质量分数变化如右图是所示。
(1)右图中的线2表示的组分为 (填化学式)。
(2)实验时,“反应II”中加入NaOH溶液的目的是 (用化学方程式表示)。
(3)国家标准规定产品中Na2SO3的质量分数≥97.0%为优等品,≥93.0%为一等品。为了确定实验所得产品的等级,研究小组采用了两种方法进行测定。
①方法I:称取2.570g产品,用蒸馏水溶解,加入足量的双氧水使Na2SO3完全氧化生成Na2SO4,再加入过量的BaCl2溶液,所得沉淀经过过滤、洗涤、干燥后称量,质量为4.660g,通过计算确定产品中Na2SO3的质量分数(写出计算过程)
②方法II:称取1.326g产品,配成100mL溶液,取25.00mL该溶液,滴加0.1250mol/L I2溶液,恰好使Na2SO3完全氧化生成Na2SO4时,消耗I2溶液20.00mL。通过计算确定产品中Na2SO3的质量分数(写出计算过程)
③判断Na2SO3产品的等级,并说明理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g) ![]() 2NO(g) △H1=+180.5 kJ·mol-1
2NO(g) △H1=+180.5 kJ·mol-1
② C和CO的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
则2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g)的△H=kJ·mol-1
N2(g) + 2CO2(g)的△H=kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
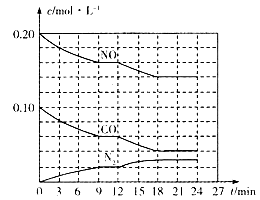
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1(保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度B.加入NO C.加催化剂D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K值为________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收,若将一定量的SO2气体通入到300mL NaOH的溶液中,再在所得溶液中逐滴加入稀盐酸至过量,产生的气体与反应的HCl两者物质的量的关系如图所示(气体的溶解和HCl的挥发忽略,NaHSO3水溶液为酸性):
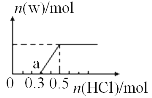
①O点溶液中所含溶质的化学式为;
②a点溶液中各离子溶度大小关系为______________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com