
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
A.CO2和H2S B.SO2和SiO2 C.NH4Cl和HCl D.CCl4和KCl
科目:高中化学 来源: 题型:
【题目】已知A的产量通常用来衡量一个国家的石油化工发展水平,B、D是饮食中两种常见的有机物,F是一种有香味的物质,F中碳原子数是D的两倍。现以A为主要原料合成F和高分子化合物E,其合成路线如图所示。
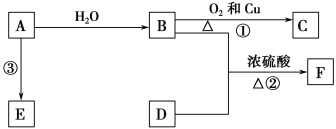
(1)A的结构式为____________,B中决定其性质的重要官能团的名称为____________。
(2)写出反应的化学方程式并判断反应类型。
①______________________________________,反应类型:____________。
③________________________,反应类型:____________。
(3)实验室怎样鉴别B和D?_________________________________________________。
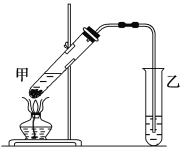
(4)该装置图中有一个明显的错误是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修2:化学与技术】
炼锌厂产生的工业废渣—锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:

已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强。
试回答下列问题:
(1)“浸出”时用到的“试剂X”为___________(填名称)。
(2)写出“氧化”过程的离子方程式____________。
(3)“调pH”过程可以选用_____________。(从以下选项选择,填序号)
A.H2SO4 B.ZnO C.NaOH D.ZnCO3
“滤渣2”的主要成分是___________(填化学式,下同)。
(4)“试剂Y”是_______________;写出除去Cd2+的化学方程式_______________。
(5)“操作1”的方法是_______________;在“操作1”时,必须采取的实验措施是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。 如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是( )

A.腐蚀过程中,负极是c
B.正极反应是O2 + 4e-+2H2O=4OH-
C.若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.224L(标准状况)
D.环境中的Cl扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )

A.工业生产中常选用NaOH作为沉淀剂
B.粗盐可采用溶解、过滤和重结晶等过程进一步提纯
C.向苦卤中通入Cl2是为了提取溴
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:

已知:HCl的沸点是﹣85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是______________。反应设备不能用玻璃材质的原因是______________________(用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的___________溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:_______________________________。
(3)第④步分离采用的方法是_________;第⑤步分离尾气中HF、HCl采用的方法是______。
(4)LiPF6产品中通常混有少量LiF。取样品wg,测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为______mol(用含w、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:

(1)③⑤⑥⑦中原子半径最大的是 (用元素符号表示,下同),②③④⑤的简单离子中半径最小的是 。
(2) ③⑤中元素的金属性强弱顺序为 ,⑥⑦元素的非金属性强弱顺序为
(3)①、②两种元素按原子个数比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)碳酸钠溶液呈碱性的原因 。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10molL-1氨水中滴入0.10molL-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10molL-1氨水的电离度为1.32%,下列有关叙述正确的是( )

A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com