
| A、CH3CH2COOCH3 |
| B、CH3COOCH2CH3 |
| C、HCOOCH2CH2CH3 |
| D、HCOOCH(CH3)2 |


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金华米酒香甜可口,不含任何化学物质 |
| B、康师傅牌矿泉水,真正的纯水 |
| C、春晖牌蔬菜,天然种植,不含任何元素,真正的绿色食品 |
| D、云梦食用合格碘盐,可预防甲状腺肿大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
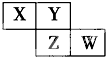 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A、原子半径:W>Z>Y>X |
| B、最高价氧化物对应水化物的酸性:Z>W>X |
| C、与H2化合,Z比W更容易 |
| D、形成的气态氢化物溶于水,溶液呈碱性的是:X |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
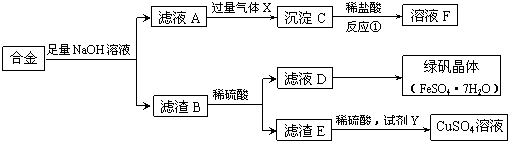
查看答案和解析>>
科目:高中化学 来源: 题型:
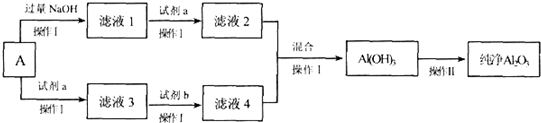
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 实验方案 | 预期现象 | |
| a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
| b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
| c | 加酸性KMnO4溶液 | 紫色褪去 |
| d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com