
下列文字表述与反应的离子方程式对应且正确的是
A.硫化钠的水解反应:S2-+H3O+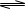 HS-+H2O
HS-+H2O
B.Fe3O4与足量稀HNO3反应:3Fe3O4 +28H++NO3-=9Fe3++NO2↑+14H2O
+28H++NO3-=9Fe3++NO2↑+14H2O
C.NaHSO4溶液与Ba(OH)2溶液混合后显中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源:2016届福建省莆田市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关金属的说法正确的是
①纯铁不容易生锈②钠着火用水扑灭③铝在空气中耐腐蚀,所以铝是不活泼金属④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金⑥KSCN溶液可以检验Fe3+
A.①④⑤⑥ B.②③④⑤ C.①③④⑤ D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第二次月考化学试卷(解析版) 题型:选择题
某溶液中,若忽略水的电离,只含有下表中所示的四种离子,推测X离子及其个数b可能为
离子 | Na+ | Al3+ | Cl- | X |
个数 | 3a | 2a | a | b |
A、NO3-、4 a B、SO42-、4 a C、OH-、4 a D、SO42-、8 a
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上第二次月考化学试卷(解析版) 题型:选择题
在甲酸的下列性质中,可以证明它是弱电解质的是
A.1mol/L甲酸溶液中c(H+)约为1×10-2mol/L
B.甲酸能与水以任意比互溶
C.10mL 1mol/L甲酸恰好跟10 mL 1mol/L NaOH溶液完全反应
D.在相同条件下,甲酸的导电性比强酸溶液的导电性弱
查看答案和解析>>
科目:高中化学 来源:2016届湖南省衡阳市高三上学期第二次月考化学试卷(解析版) 题型:实验题
(12分)钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:

已知:i.Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii.Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii.KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3
溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(3)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④Ba(OH)2
(4)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(5)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第一次月考化学试卷(解析版) 题型:选择题
某工厂排出的废液中含有Ba2+、Ag+、Cu2+,用①Na2SO4溶液,②NaOH溶液,③盐酸三种试剂将它们逐一沉淀并加以分离,加入试剂的正确顺序是
A.②③① B.②①③ C.①②③ D.③①②
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。下列说法正确的是
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式 | 电离常数(298 K) |
硼酸 | K=5.7×10-10 |
碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
醋酸 | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期10月月考化学试卷(解析版) 题型:选择题
用试纸检验气体性质是一种重要的实验方法。如下表所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是
选项 | 物质 | 试纸名称 | 现象 | 性质 |
A | Na2SO3、硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
B | 浓氨水、生石灰 | 蓝色石蕊溶液 | 变红 | 氨气为碱性气体 |
C | 碘水 | 淀粉试纸 | 变蓝 | 碘具有氧化性 |
D | Cu、浓硝酸 | KI淀粉试纸 | 变蓝 | NO2为酸性气体 |
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上学期第一次月考化学试卷(解析版) 题型:实验题
“8.12”天津港爆炸中有一定量的氰化物泄露。氰化物多数易溶于水,有剧毒,易造成水污染。为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(1)NaCN溶液呈碱性的原因是 (用离子方程式表示)
(2)下列选项错误的是
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
(3)H2O2有有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-) c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验。将CN-的浓度为0.2000 mol/L的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
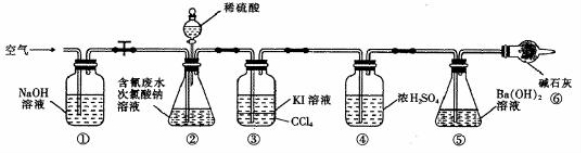
已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl-
2CNO-+2H+ + 3C1O-=N2↑+2CO2↑+ 3C1-+H2O
(5)①和⑥的作用是 。
(6)反应结束后,缓缓通入空气的目的是 。
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置 反应前后的质量(从装置①到⑥中选择,填装置序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com