
| A、BeCl2和BF3 |
| B、H2O和NH3 |
| C、CO2和SO2 |
| D、HCHO和PCl3 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 6-2×1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
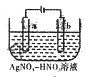 金属冶炼与处理常涉及氧化还原反应
金属冶炼与处理常涉及氧化还原反应查看答案和解析>>
科目:高中化学 来源: 题型:
 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①③ |
| B、只有①③④ |
| C、只有①③④⑤ |
| D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①④ | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe<Zn<Mg |
| B、Zn<Fe<Mg |
| C、Fe<Mg<Zn |
| D、Zn<Mg<Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 g钠投入100 g水中,溶液的总质量为100 g |
| B、1 g表面被氧化的金属钠投入100 g水中,溶液的总质量为101 g |
| C、1 g氧化钠投入100 g水中,溶液的总质量为101 g |
| D、1 g过氧化钠投入100 g水中,溶液的总质量为101 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、c<a<0 |
| B、b>d>0 |
| C、2a=b<0 |
| D、2c=d>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com