
【题目】大气污染越来越成为人们关注的问题,烟气中的 NOx 必须脱除(即脱硝)后才能排放。
(1)已知:CH4(g)+2O2 (g)===CO2(g)+2H2O(1) ΔH=-890.3 kJ·mol-1;N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1;CH4 可用于脱硝,其热化学方程式为:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(1),ΔH=_____。
(2)C2H4 也可用于烟气脱硝。为研究温度、催化剂中 Cu2+负载量对 NO 去除率的影响,控制其它条件一定,实验结果如图 所示。为达到最高的 NO 去除率,应选择的反应温度和 Cu2+负 载量分别是_____。

(3)臭氧也可用于烟气脱硝。一种臭氧发生装置原理如图 所示。阳极(惰性电极)的电极反应 式为_____。
(4) NO 直接催化分解(生成 N2 与 O2)也是一种脱硝途径。在不同条件下, NO 的分解产物不同。在高压下,NO 在 40 ℃下分解生成两种化合物, 体系中各组分物质的量随时间变化曲线如图 所示。写出 Y 和 Z 的化 学式: _____。

【答案】-1250.3kJ·mol1 350℃左右、3% 3H2O-6e=O3↑+6H+ N2O、NO2
【解析】
(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJmol-1,②N2(g)+O2(g)═2NO(g) △H=+180kJmol-1,根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),据此计算;
(2)根据图象找出NO去除率最高时对应的温度和催化剂中Cu2+负载量;
(3)酸性条件下,水在阳极失电子生成臭氧;
(4)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,由图象可知3molNO生成两种氮的氧化物各为1mol,根据原子守恒判断产物。
(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3kJmol-1,②N2(g)+O2(g)═2NO(g);△H=+180kJmol-1,根据盖斯定律:①-2×②得CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l),△H=-890.3kJmol-1-2×(+180kJmol-1)=-1250.3 kJmol-1,故答案为:-1250.3 kJmol-1;
(2)由图1可知在350℃左右,催化剂中Cu2+负载量为3%时,NO去除率最高,故答案为:350℃左右、3%;
(3)酸性条件下,水在阳极失电子生成臭氧,生成1mol臭氧转移6mol电子,则电极方程式为:3H2O-6e-═O3↑+6H+,故答案为:3H2O-6e-═O3↑+6H+;
(4)NO在40℃下分解生成两种化合物,根据元素守恒可知生成的为N的氧化物,氮元素的氧化物有NO、N2O、NO2、N2O3、N2O4、N2O5,由图象可知3molNO生成两种氮的氧化物各为1mol,其反应方程式为:3NO=Y+Z,根据原子守恒可知为N2O、NO2,故答案为:N2O、NO2。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
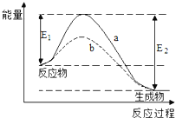
A. 该反应为吸热反应
B. a与b相比,a的反应速率更快
C. a与b相比,反应的平衡常数一定不同
D. 反应物吸收的总能量小于生成物释放的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示.则下列结论正确的是( )

A.该反应的热化学方程式![]() △H>0
△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)具有两性特征,铜阳极泥是提取碲的主要原料,碲在铜阳极泥中主要以Me2Te(Me表示金属Cu、Pb、Au、Ag等)的形式存在。
(1)利用“氯化浸出-还原法”制备Te的工艺流程如下所示。

①浸出液的主要成分为CuSO4、 HAuCl4、H2TeO3,则浸出渣的主要成分为___________(填化学式);“浸出”过程中,加入NaCl的作用是___________。“浸出”过程中,有少量污染性气体生成,需要进行尾气处理,该气体是___________(填化学名称)
②已知 HAuCl4是一种强酸,则“一级还原”过程中发生反应的离子方程式为___________。
③欲得到64g碲,则“二级还原”过程中至少需通入___________mol SO2。
(2)“氧化碱浸-电解法”指的是在氧化剂的作用下,Cu2Te与NaOH溶液反应生成Na2TeO3,经电解即可获得Te。
①以空气为氧化剂进行“氧化碱浸”的化学方程式为___________。
②电解过程中,阴极的电极反应式为___________。
③与“氯化浸出-还原法”相比“氧化碱浸-电解法”的优点是___________(任写一点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是

A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸俗称草酸(结构简式为HOOCCOOH,可简写为H2C2O4)。25℃时,草酸钙的Ksp=4.0×108,碳酸钙的Ksp=2.5×109。回答下列问题:
(1)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×104mol/L的草酸钾溶液20mL,能否产生沉淀________(填“能”或“不能”)。
(2)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
I.实验前首先用浓度为0.1000molL1酸性KMnO4标准溶液滴定未知浓度的草酸。
①滴定过程中操作滴定管的图示正确的是________(填编号)。

②判断滴定终点的方法是:________。
③若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度__________(填“偏高”或“偏低”或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000molL1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号 | 温度 (℃) | 催化剂用量 (g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 | |
体积(mL) | 浓度(molL1) | ||||
1 | 25 | 0.5 | 4 | 0.1000 | |
b.实验1和3探究反应物浓度对该反应速率的影响;c.实验1和4探究催化剂对该反应速率的影响。 | |||||
2 | 50 | 0.5 | 4 | 0.1000 | |
3 | 25 | 0.5 | 4 | 0.0100 | |
4 | 25 | 0 | 4 | 0.1000 | |
④写出表中a对应的实验目的________;
⑤该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间(min) | ||
第1次 | 第2次 | 第3次 | |
1 | 14.0 | 13.0 | 11.0 |
3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
A. Na的还原性强于金刚石B. 另一种化合物是NaCl
C. 纳米级金刚石粉末可以透过半透膜D. 这个反应是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬是硬度最高的金属,常用于制造不锈钢和仪器仪表的金属表面镀铬,可用铬铁矿(主要成分为FeCr2O4,含有SiO2、Al2O3等杂质)冶炼金属铬。回答下列问题:
I.焦炭冶炼法。反应的化学方程式为FeCr2O4+4C![]() Fe+2Cr+4CO ,该方法的优点是过程简单,主要缺点是___。
Fe+2Cr+4CO ,该方法的优点是过程简单,主要缺点是___。
Ⅱ.铝热冶炼法。冶炼流程如下:

已知:4FeCr2O4+8Na2CO3 +7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①所得浸出液中的阴离子除CrO42-、CO32-、OH-外,还有____(忽略水解,填化学式)。
(2)步骤③需将pH调____(填“大”或“小”)。
(3)步骤④反应的离子方程式为____。若加H2SO4前c(CrO42-) =0. 020 mol/L,将溶液pH调至3时CrO42-浓度降为1.0×10-5 mol/L(加入H2SO4引起的体积变化可忽略),则该反应的平衡常数为____
(4)相关物质的溶解度曲线如图。步骤⑤需先得到较纯的 Na2Cr2O7·2H2O晶体,其操作方法是____。

(5)步骤⑥除生成Cr2O3外,还生成了Na2CO3和CO,该反应中氧化剂与还原剂的物质的量之比为 ___。可改用Na2 CrO4和Na2S反应得到Cr(OH)3,再热分 解得到Cr2O3。请配平下列化学方程式:___Na2CrO4+___Na2S+___H2O =___Cr(OH)3+___Na2 S2O3+___NaOH___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com