
【题目】碲(Te)具有两性特征,铜阳极泥是提取碲的主要原料,碲在铜阳极泥中主要以Me2Te(Me表示金属Cu、Pb、Au、Ag等)的形式存在。
(1)利用“氯化浸出-还原法”制备Te的工艺流程如下所示。

①浸出液的主要成分为CuSO4、 HAuCl4、H2TeO3,则浸出渣的主要成分为___________(填化学式);“浸出”过程中,加入NaCl的作用是___________。“浸出”过程中,有少量污染性气体生成,需要进行尾气处理,该气体是___________(填化学名称)
②已知 HAuCl4是一种强酸,则“一级还原”过程中发生反应的离子方程式为___________。
③欲得到64g碲,则“二级还原”过程中至少需通入___________mol SO2。
(2)“氧化碱浸-电解法”指的是在氧化剂的作用下,Cu2Te与NaOH溶液反应生成Na2TeO3,经电解即可获得Te。
①以空气为氧化剂进行“氧化碱浸”的化学方程式为___________。
②电解过程中,阴极的电极反应式为___________。
③与“氯化浸出-还原法”相比“氧化碱浸-电解法”的优点是___________(任写一点)
【答案】PbSO4和AgCl 增大氯离子浓度,有利于HAuCl4的生成 氯气 [AuCl4]-+3Fe2+=3Fe3++Au+4Cl- 1 Cu2Te+2O2+2NaOH+H2O=Na2TeO3+2Cu(OH)2 TeO32-+4e-+3H2O=Te+6OH- 不生成氯气等污染性气体(或工艺简单)
【解析】
(1)①Pb和Ag被氧化成Pb2+和Ag+,随后分别与SO42-和Cl-形成沉淀PbSO4和AgCl,浸出渣的主要成分为PbSO4和AgCl。NaCl中Cl-与溶液中的氧化得到的少量Au3+络合,形成四氯合金离子([AuCl4]-),促进Au的溶解,同时使Ag+沉淀。NaClO3和NaCl反应生成氯气Cl2,故“浸出”过程中需要进行尾气处理的污染性气体是Cl2。
②“一级还原”过程中发生反应的离子方程式为:[AuCl4]-+3Fe2+=3Fe3++Au↓+4Cl-;
③H2TeO3→Te,Te元素化合价变了4价,SO2→SO42-,硫元素化合价变了2价,根据得失电子守恒有0.5mol×4=n(SO2)×2(其中64g的碲为0.5mol),解得n(SO2)=1mol。
(2)①在氧化剂的作用下,Cu2Te与NaOH溶液反应生成Na2TeO3,化学方程式为Cu2Te+2O2+2NaOH+H2O=Na2TeO3+2Cu(OH)2。
②若用惰性电极电解溶液,在阴极上TeO32-得到电子生成Te,电极反应式为TeO32-+4e-+3H2O=Te+6OH-。
③根据以上分析可知与“氯化浸出-还原法”相比“氧化碱浸-电解法”的优点是如不产生氯气等污染性气体,反应步骤少,简便,成本低等。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12。如图是向10mLAgNO3溶液中逐渐加入0.1mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论不正确的是( )[提示:Ksp(AgCl)>Ksp(AgI)]

A. 原AgNO3溶液的物质的量浓度为1mol·L-1
B. 图中x点的坐标为(100,6)
C. 图中x点表示溶液中AgNO3与NaCl恰好完全反应
D. 把0.1mol·L-1的NaCl换成0.1mol·L-1NaI则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是
A.  正极的电极反应式为MnO2+H2O+e-=MnOOH+OH-
正极的电极反应式为MnO2+H2O+e-=MnOOH+OH-
B.  放电时,外电路中通过2mol电子,理论上正极质量增加96g
放电时,外电路中通过2mol电子,理论上正极质量增加96g
C.  阳极质量的减小值等于阴极质量的增加值
阳极质量的减小值等于阴极质量的增加值
D.  电池的总反应及电极反应均与电解质溶液的酸碱性无关
电池的总反应及电极反应均与电解质溶液的酸碱性无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Na 与 H2O 的反应是熵增的放热反应,该反应能自发进行
B. 饱和 NaCl 溶液加入浓盐酸析出晶体,易溶电解质也存在溶解平衡
C. FeCl3 和 MnO2 均可加快 H2O2 分解,同等条件下二者对 H2O2 分解速率的改变相同
D. Mg(OH)2 固体在溶液中存在平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用多孔石墨电极完成下列实验。下列解释或推理合理的是
实验 |
| ||
现象 | I中,a.b两极均有气泡产生 | II,a极上析出红色固体 | III,a极上析出灰白色固体 |
A. Ⅰ中电解一段时间后,c(Na2SO4)一定增大
B. 由Ⅱ中反应H2+Cu2+=Cu↓+2H+可知,用玻璃导管将H2通入CuSO4溶液中,也会产生红色沉淀
C. Ⅲ中,只可能发生反应2Ag++Cu===Cu2++2Ag
D. I中,a极上既发生了化学变化,也发生了物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,Fe、HCN与K2CO3可发生反应Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O。请回答下列问题:
(1)金属铁的堆积方式为___________,其配位数为___________。
(2)HCN分子的结构式为___________,写出一种与CN-互为等电子体的阴离子:___________。
(3)键角NH3___________(填“>”“<”或“=")NF3,原因是___________。
(4)K4Fe(CN)6的中心离子的核外电子排布式为___________。
(5)C、N、O、H的第一电离能由小到大的顺序为___________。
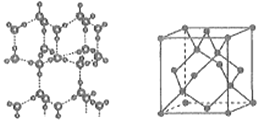
(6)冰的晶体结构模型如图所示,其晶胞结构(如图所示)与金刚石的晶胞结构相似,水分子间以氢键相连,则一个晶胞中含有___________个氢键,用NA表示阿伏加德罗常数的值,若氢键的键长为dnm,则晶体密度ρ=___________g·cm-3(用含有d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染越来越成为人们关注的问题,烟气中的 NOx 必须脱除(即脱硝)后才能排放。
(1)已知:CH4(g)+2O2 (g)===CO2(g)+2H2O(1) ΔH=-890.3 kJ·mol-1;N2(g)+O2(g)===2NO(g) ΔH=+180 kJ·mol-1;CH4 可用于脱硝,其热化学方程式为:CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(1),ΔH=_____。
(2)C2H4 也可用于烟气脱硝。为研究温度、催化剂中 Cu2+负载量对 NO 去除率的影响,控制其它条件一定,实验结果如图 所示。为达到最高的 NO 去除率,应选择的反应温度和 Cu2+负 载量分别是_____。

(3)臭氧也可用于烟气脱硝。一种臭氧发生装置原理如图 所示。阳极(惰性电极)的电极反应 式为_____。
(4) NO 直接催化分解(生成 N2 与 O2)也是一种脱硝途径。在不同条件下, NO 的分解产物不同。在高压下,NO 在 40 ℃下分解生成两种化合物, 体系中各组分物质的量随时间变化曲线如图 所示。写出 Y 和 Z 的化 学式: _____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:A(S)+B(g)![]() C(g)+ D(g)ΔH<0,达到平衡时,改变单一条件,下列说法正确的是()
C(g)+ D(g)ΔH<0,达到平衡时,改变单一条件,下列说法正确的是()
A. 恒温环境下加压,体系的平均相对分子质量一定升高
B. 反应速率再次满足υC:υD=1:1时,则反应达到平衡状态
C. 恒温恒容下,当物质A的质量不再改变,则反应达到平衡状态
D. 物质A由块状变为粉末状,正反应速率加快,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿在生产中有广泛的应用。

(1)过程Ⅰ:软锰矿的酸浸处理
① 酸浸过程中的主要反应(将方程式补充完整):2FeS2+___MnO2+__===____Mn2++2Fe3++4S+___。
② 生成的硫附着在矿粉颗粒表面使上述反应受阻,此时加入H2O2,利用其迅速分解产生的大量气体破除附着的硫。导致H2O2迅速分解的因素是______。
③矿粉颗粒表面附着的硫被破除后,H2O2可以继续与MnO2反应,从而提高锰元素的浸出率,该反应的离子方程式是______。
(2)过程Ⅱ:电解法制备金属锰,金属锰在______(填“阳”或“阴”)极析出。
(3)过程Ⅲ:制备Mn3O4

下图表示通入O2时pH随时间的变化。15~150分钟滤饼中一定参与反应的成分是______,判断的理由是______。

(4)过程Ⅳ:制备MnCO3
MnCO3难溶于水、能溶于强酸,可用MnSO4溶液和NH4HCO3溶液混合制备。每制得1 mol MnCO3,至少消耗a mol/L NH4HCO3溶液的体积为______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com