
【题目】下列为四个常用的电化学装置,关于它们的叙述正确的是
A.  正极的电极反应式为MnO2+H2O+e-=MnOOH+OH-
正极的电极反应式为MnO2+H2O+e-=MnOOH+OH-
B.  放电时,外电路中通过2mol电子,理论上正极质量增加96g
放电时,外电路中通过2mol电子,理论上正极质量增加96g
C.  阳极质量的减小值等于阴极质量的增加值
阳极质量的减小值等于阴极质量的增加值
D.  电池的总反应及电极反应均与电解质溶液的酸碱性无关
电池的总反应及电极反应均与电解质溶液的酸碱性无关
【答案】A
【解析】
A项、碱性锌锰干电池中碳棒做正极,MnO2在正极上发生还原反应,电极反应式为MnO2+H2O+e-=MnOOH+OH-,故A正确;
B项、铅蓄电池中PbO2为正极,PbO2在正极上发生还原反应,电极反应式为PbO2+4H++ SO42-+2e-=PbSO4+2H2O,由电极反应式可知,外电路中通过2mol电子,理论上正极质量增加64g,故B错误;
C项、由于粗铜中含有较活泼的铁、锌等杂质,电解时Fe、Zn优先放电,则电解精炼铜过程中,阳极质量的减少值与阴极质量的增加值不一定相等,故C错误;
D项、氢氧燃烧电池的总反应与电解质溶液的酸碱性无关,但电极反应与电解质溶液的酸碱性有关,如碱性溶液中正极反应式为O2+2H2O+4e-===4OH-,酸性溶液中正极反应式为O2+4H++4e-===2H2O,故D错误。
故选A。


科目:高中化学 来源: 题型:
【题目】如图所示为组成人体细胞的主要的元素及其比例。下列相关叙述中,错误的是( )

A.图中所示为细胞鲜重中主要的元素的所占比例
B.因为 O 的含量最多,所以 O 是构成有机物的最基本元素
C.细胞干重中,C 所占比例最大
D.图中所示的元素在非生物界也可以找到
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
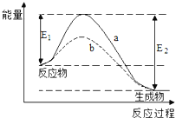
A. 该反应为吸热反应
B. a与b相比,a的反应速率更快
C. a与b相比,反应的平衡常数一定不同
D. 反应物吸收的总能量小于生成物释放的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究金属腐蚀和防腐的原理很有现实意义。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有________(填序号)。

A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更细的导管,水中滴加红墨水
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐_______________(填“加快”、“不变”、“减慢”), 你认为影响因素为________________________________________
时间/min | 1 | 3 | 5 | 7 | 9 |
液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(3)为探究铁钉腐蚀实验 a、b 两点所发生的反应,进行以下实验,请完成表格空白:
实验操作 | 实验现象 | 实验结论 |
向 NaCl溶液中滴加 2~3 滴酚酞指示剂 | a 点附近溶液出现红色 | a 点电极反应为①___________________ |
然后再滴加 2~3 滴②________________ | b 点周围出现蓝色沉淀 | b 点电极反应为③___________________ |
根据以上实验探究,试判断____________(填“a”或“b”)为负极,该点腐蚀更严重。
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见下图,从图中可分析,t1~t2 之间主要发生__________ 腐蚀(填吸氧或析氢),原因是__________________________________________。

(5)金属阳极钝化是一种电化学防腐方法。将 Fe 作阳极置于 H2SO4 溶液中,一定条件下Fe 钝化形成致密 Fe3O4 氧化膜,试写出该阳极电极反应式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 一水合氨的电离:NH3·H2O=NH4++OH-
C. 食醋除去水垢中的碳酸钙:CaCO3+2H+=Ca2++CO2↑+H2O
D. 氯气与氢氧化钠溶液反应:Cl2+2OH- =Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中,向Na2CO3溶液中通入SO2气体制备无水Na2SO3,水溶液中H2SO3、HSO3-、SO32-粒子的物质的量分数随pH的分布、Na2SO3的溶解度曲线如图所示:

下列说法不正确的是:
A. 溶液pH=4时,溶质为NaHSO3
B. 溶液pH=10时,c(Na+)+ c(H+)= c(OH–)+ c(SO32–)+ c(HSO3–)
C. 溶液pH=7时, c(SO32–)= c(HSO3–)
D. 溶液pH=10时,停止通入SO2,将溶液加热浓缩至有大量晶体析出,在高于34℃趁热过滤、洗涤、干燥得到无水Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示.则下列结论正确的是( )

A.该反应的热化学方程式![]() △H>0
△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)具有两性特征,铜阳极泥是提取碲的主要原料,碲在铜阳极泥中主要以Me2Te(Me表示金属Cu、Pb、Au、Ag等)的形式存在。
(1)利用“氯化浸出-还原法”制备Te的工艺流程如下所示。

①浸出液的主要成分为CuSO4、 HAuCl4、H2TeO3,则浸出渣的主要成分为___________(填化学式);“浸出”过程中,加入NaCl的作用是___________。“浸出”过程中,有少量污染性气体生成,需要进行尾气处理,该气体是___________(填化学名称)
②已知 HAuCl4是一种强酸,则“一级还原”过程中发生反应的离子方程式为___________。
③欲得到64g碲,则“二级还原”过程中至少需通入___________mol SO2。
(2)“氧化碱浸-电解法”指的是在氧化剂的作用下,Cu2Te与NaOH溶液反应生成Na2TeO3,经电解即可获得Te。
①以空气为氧化剂进行“氧化碱浸”的化学方程式为___________。
②电解过程中,阴极的电极反应式为___________。
③与“氯化浸出-还原法”相比“氧化碱浸-电解法”的优点是___________(任写一点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
A. Na的还原性强于金刚石B. 另一种化合物是NaCl
C. 纳米级金刚石粉末可以透过半透膜D. 这个反应是置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com