
A、 闻气味 |
B、 量取液体 |
C、 将乙醇与水分离 |
D、 检查装置的气密性 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:


| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验.
某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验. -ONa溶液的pH,其pH由大到小排列的顺序为
-ONa溶液的pH,其pH由大到小排列的顺序为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+6H+=3I2+3H2O |
| B、氯气与水反应:Cl2+H2O=2H++Cl-+ClO- |
| C、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| D、钠与水的反应:Na+H2O=Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、溶液A的溶质是NaOH |
| B、阴极附近溶液pH升高 |
| C、气体a为氯气,其电极反应为2Cl--2e-═Cl2↑ |
| D、与产生气体b的电极相连的是电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 如图装置可测定反应速率 |
B、 用如图装置制备Fe(OH)2 |
C、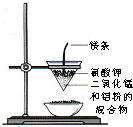 用如图装置制取少量金属锰 |
D、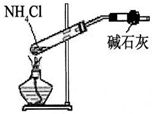 实验室用如图所示装置制取少量氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入滴加BaCl2溶液,立即产生白色沉淀 | 原溶液中一定有SO42- |
| B | 在K2CrO7溶液中加入NaOH溶液,溶液由橙色变为黄色 | K2CrO7与NaOH溶液发生了氧化还原反应 |
| C | 在滴有酚酞的Na2CO3溶液中,滴加入BaCl2溶液,溶液红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
| D | 用铂丝蘸取溶液进行颜色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若v1=v2c1=c2,则混合液中c(NH4+)=c(C1-) |
| B、若混合液的pH=7,则混合液中c(NH4+)>c(C1-) |
| C、若v1=v2且pH<7,则一定有c1<c2 |
| D、若混合液的pH=7,则c1v1>c2v2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①H2SO4溶液中H2SO4 | ①H2SO4溶液中HSO4- | ②NaHSO4溶液中HSO4- | ③CH3COOH 溶液 |
④HCl溶液 |
| 100% | 10% | 29% | 1.3% | 100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com