
| c值范围 | 被氧化的离子符号 | 被氧化离子的物质的量/mol |
| 0<c≤a | ① | ② |
| a<c≤$\frac{3a+b}{2}$ | ③ | ④ |
| $\frac{3a+b}{2}$<c≤3$\frac{a+b}{2}$ | ⑤ | ⑥ |
分析 向FeI2和FeBr2的混合液中逐渐通入Cl2,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子;通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,即Cl2+2I-═2Cl-+I2,2Fe2++Cl2═2Fe3++2Cl-,Cl2+2Br-═2Cl-+Br2.
解答 解:通入氯气后,碘离子先被氧化,Cl2+2I-═2Cl-+I2,其次是亚铁离子,2Fe2++Cl2═2Fe3++2Cl-,最后是溴离子Cl2+2Br-═2Cl-+Br2,在通入氯气的量为0<c≤a的过程中,碘离子被氧化,被氧化碘离子的物质的量是2cmol;在通入氯气的量为a<c≤$\frac{3a+b}{2}$的过程中,碘离子被氧化完毕,被氧化的是亚铁离子,发生反应:2Fe2++Cl2═2Fe3++2Cl-,被氧化的亚铁离子物质的量是(2c-2a)mol,当通入氯气的量为$\frac{3a+b}{2}$<c≤$\frac{a+b}{2}$亚铁离子被氧化完毕,被氧化的是溴离子,发生反应:,Cl2+2Br-═2Cl-+Br2,被氧化的溴离子物质的量是(2c-3a-b)mol;
故答案为:①I- ②2c ③Fe2+ ④2c-2a ⑤Br- ⑥2c-3a-b.
点评 本题考查混合物反应的计算,题目难度中等,侧重考查氧化还原反应中氧化性和还原性强弱的知识,试题综合性较强.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 硫具有还原性,可用硫粉覆盖地上洒落的汞 | |
| D. | 硅是重要的半导体材料,常用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol•(L•min)-1 | |
| B. | 2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的 | |
| C. | 2 min末的反应速率用B表示是0.3 mol•(L•min)-1 | |
| D. | 分别用B、C、D表示的反应速率其比值是3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

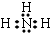 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐材料 | |
| B. | 用于制作灯饰外壳材料的聚苯乙烯塑料属于有机高分子材料 | |
| C. | 氮化硅结构陶瓷可以用来做发动机的部件 | |
| D. | 高吸水性材料、光敏性材料等属于功能高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl NaHSO4 KHCO3 | B. | Na2SO4 BaCl2 Na2CO3 | ||
| C. | NaHCO3 Ba(OH)2 NaHSO4 | D. | Ca(OH)2 Na2CO3 BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2.3 g Na投入到97.7 g水中充分反应,所得溶液的质量分数为4.0% | |
| B. | 相同质量的铝分别与足量的盐酸和NaOH溶液反应,生成气体物质的量之比为1:3 | |
| C. | 将CO2和H2O的混合气体a mol,与足量的Na2O2固体充分反应,生成的O2在标准状况下的体积为11.2a L | |
| D. | 120 mL含有0.20 mol碳酸钠的溶液与200 mL盐酸进行滴加反应,不管将前者滴入后者,还是后者滴入前者,滴加完全后,产生的气体在相同条件下体积不等,则盐酸的浓度可能为2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | a=2b | C. | 2a=b | D. | 以上都不对 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com