
| A. | KCl NaHSO4 KHCO3 | B. | Na2SO4 BaCl2 Na2CO3 | ||
| C. | NaHCO3 Ba(OH)2 NaHSO4 | D. | Ca(OH)2 Na2CO3 BaCl2 |
分析 A.NaHSO4、KHCO3反应生成气体,与量无关,均与KCl不反应;
B.Na2SO4、Na2CO3均与BaCl2反应生成白色沉淀;
C.NaHCO3、NaHSO4均与 Ba(OH)2反应生成白色沉淀,且NaHCO3、NaHSO4反应生成气体;
D.Ca(OH)2、BaCl2均与Na2CO3反应生成白色沉淀.
解答 解:A.NaHSO4、KHCO3反应生成气体,与量无关,均与KCl不反应,不用其它试剂不能鉴别,故A不选;
B.Na2SO4、Na2CO3均与BaCl2反应生成白色沉淀,不用其它试剂不能鉴别,故B不选;
C.NaHCO3、NaHSO4均与 Ba(OH)2反应生成白色沉淀,且NaHCO3、NaHSO4反应生成气体,不用其它试剂即可鉴别,故C选;
D.Ca(OH)2、BaCl2均与Na2CO3反应生成白色沉淀,不用其它试剂不能鉴别,故D不选;
故选C.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如改变体系温度,体系颜色一定发生变化 | |
| B. | 如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移 | |
| C. | 继续充入HI气体,则HI的转化率将减小 | |
| D. | 温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的硬度一般比各组分金属的低 | B. | 合金中可能含有非金属元素 | ||
| C. | 合金中肯定含有金属元素 | D. | 合金的熔点一般比各组分金属的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| c值范围 | 被氧化的离子符号 | 被氧化离子的物质的量/mol |
| 0<c≤a | ① | ② |
| a<c≤$\frac{3a+b}{2}$ | ③ | ④ |
| $\frac{3a+b}{2}$<c≤3$\frac{a+b}{2}$ | ⑤ | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
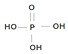 (为三元中强酸),三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构简式为
(为三元中强酸),三聚磷酸可视为三个磷酸分子之间脱去两个水分子的产物,其结构简式为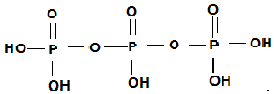 ;三聚磷酸钠是常用的水处理剂,其化学式为Na5P3O10.
;三聚磷酸钠是常用的水处理剂,其化学式为Na5P3O10.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com