
【题目】下列有机反应属于加成反应的是
A.C6H12O6+6O2→6CO2+6H2O
B.CH2=CH2+HBr→CH3CH2Br
C.2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
D.![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】用磷铁渣(含Fe、FeP、Fe2P及少量杂质)制备FePO4·2H2O(磷酸铁)的工艺流程如下:
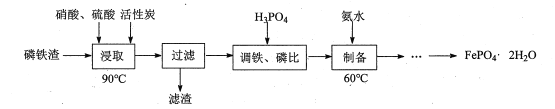
(1)“浸取”时,在密闭反应器中加入硝酸、硫酸及活性炭,硝酸首先分解生成NO2和O2,O2将铁和磷分别氧化为Fe2O3、P2O5。
①Fe2P与O2反应的化学方程式为__________。
②加入硫酸的目的是__________;加入活性炭能降低有害气体的产生,这是因为__________。
③c(HNO3)与磷铁渣溶解率关系,如题图-1所示,当c(HNO3)在1.5~2.0mol·L-1时,磷铁渣溶解率随硝酸的浓度增大而减小的原因是__________
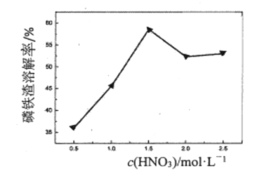 图-1
图-1
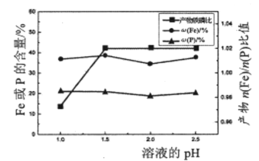 图-2
图-2
(2)“制备”时,溶液的pH对磷酸铁产品中铁和磷的含量及n(Fe)/n(P)比值的影响,如题图-2所示(考虑到微量金属杂质,在pH=1时,n(Fe)/n(P)为0.973最接近理论值])。在pH范围为1~1.5时,随pH增大,n(Fe)/n(P)明显增大,其原因是___________;写出生成FePO4·2H2O的离子方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。下图是以硫酸氧钛为原料制备纳米二氧化钛的工艺流程图:
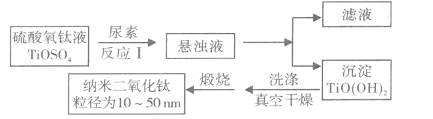
回答下列问题:
(1)反应I中发生两个反应,其一是尿素[CO(NH2)2]与H2O反应生成CO2和NH3·H2O,则另一反应的离子方程式为____。
(2)判断TiO(OH)2沉淀是否洗净的实验操作和现象是:____。
(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过____、____、_____(填基本操作)即可回收________(填化学式)。
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米二氧化钛产率的影响。设计如下实验:
实验编号 | 反应温度/℃ | 反应时间/h | 反应物物质的量配比 |
① | 90 | 1 | 2:1 |
② | 90 | 2 | 3:1 |
③ | 90 | 1 | |
④ | 100 | 2 | 3:1 |
实验②和④的实验目的是___,实验③中反应物物质的量配比为___。反应I中TiO2+浓度对TiO2的产率和粒径的影响如图:
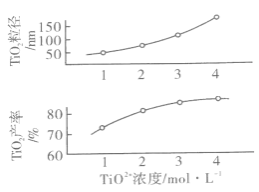
结合图中信息,你认为为达到工艺目的,最合适的TiO2+浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,Q和Y在周期表中的位置相邻,请回答下列问题:
(1)写出单质R的一种工业用途_______________________。
(2)M和R的最高价氧化物的水化物中酸性最强的是___________(用化学式表示)。
(3)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式为____________________。
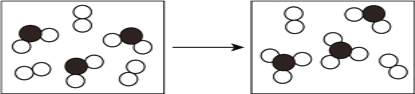
(4)由X、Y、Z、M四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。
(5)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,已知QX5中含有离子键和极性键,写出化合物的电子式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A. 有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B. 工业上通过电解氯化钠溶液制备金属钠和氯气
C. 室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D. 用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国北卡罗来纳大学的一项新研究表明,一种名为EIDD2801的新药有望改变医生治疗新冠肺炎的方式,有效减少肺损伤。其结构式如图:
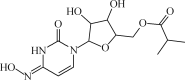
下列有关EIDD2801的说法正确的是( )
A.EIDD2801属于芳香族化合物
B.EIDD2801含有5个手性碳原子
C.EIDD2801能和NaOH溶液反应
D.EIDD2801不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有8种短周期元素,随着原子序数的递增(横坐标),其原子半径相对大小、最高正价或最低负价的变化情况如图所示。
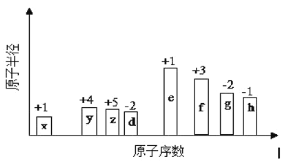
(1)元素h在周期表中的位置是____________。
(2)元素x和y形成的最简单化合物在家庭生活中的用途是____________。
(3)元素e、f最高价氧化物对应水化物的碱性强的是____________。(写化学式)
(4)元素z、x可形成原子个数比为1﹕3的化合物,其电子式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2SO4的质量为98g·mol-1
B. H2SO4的摩尔质量为98g
C. 6.02×1022个H2SO4分子的质量为9.8g
D. 9.8 g H2SO4含有6.02×1023个H2SO4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.2g铜与过量硝酸(8mol·L-1、30mL)充分反应,硝酸的还原产物为二氧化氮和一氧化氮,反应后溶液中含amol氢离子,则此时溶液中所含硝酸根离子的物质的量为( )
A.(0.2+a)molB.(0.1+a)mol
C.(0.05+a)molD.amol
【答案】B
【解析】
铜与浓硝酸可能发生反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。硝酸铜的物质的量为![]() =0.05mol,溶液中所含硝酸根离子的物质的量为0.05mol×2+amol=(0.1+a)mol,故答案为B。
=0.05mol,溶液中所含硝酸根离子的物质的量为0.05mol×2+amol=(0.1+a)mol,故答案为B。
【点睛】
考查化学方程式的计算。注意浓硝酸和稀硝酸的性质的不同,明确二氧化氮或一氧化氮和硝酸的关系以及铜与硝酸(表现酸性)的关系式是解本题的关键。铜和硝酸反应,随着浓度的减少,硝酸的还原产物的价态越低,铜和浓硝酸反应生成NO2,而与稀硝酸反应时则生成NO,故生成的气体有NO2和NO,根据混合气体的物质的量可得被还原的硝酸的物质的量,根据生成硝酸铜的物质的量可知表现酸性的硝酸的物质的量。
【题型】单选题
【结束】
11
【题目】为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面生成Fe3O4的致密保护层——“发蓝”。化学处理过程中其中一步的反应为3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑。下列叙述不正确的是( )
A.钢铁零件“发蓝”实质上是使铁表面钝化
B.上述反应中,铁被氧化
C.NO2-的氧化性大于FeO22-的氧化性
D.反应中转移2mol电子,生成还原产物8.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com