
含铜物质是化学中的重要试剂。例如利用新制氢氧化铜悬浊液验证葡萄糖的还原性。新制氢氧化铜悬浊液的配制与应用:
(1)实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的________溶液2mL,滴入2%的_________溶液4~6滴(以上选填“硫酸铜”或“氢氧化钠”),振荡即成。这样操作的目的_______________________________________________。
(2)下列各组物质的溶液仅用新制的氢氧化铜悬浊液(必要时可以加热)不能检验出来的是______。
A.HCOOCH3、C6H5COOH、C6H5CH2OH
B.NaHSO4、BaCl2、Na2CO3、酚酞
C.HCOOH、HCOONa、HCOOCH2CH3
D.葡萄糖、CH2OHCHOHCH2OH 、 CH3CHO 、 CH3CH2OH
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
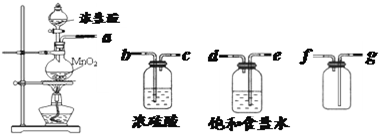
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 |
固体物质中有FeCl3 | |
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液色 不褪色 |
固体物质中不含______ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
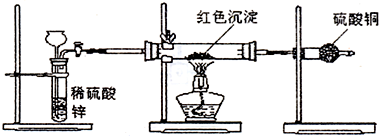
氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证醛类物质的还原性。
(1)新制氢氧化铜悬浊液的配制 实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2 mL,滴入2%的硫酸铜溶液4滴∽6滴,振荡即成。这样操作的目的是 。
下面是三个研究性学习组分别从不同层面开展研究性学习活动:
(2)研究性学习小组甲:对教材实验结论"乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O"提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究:提出猜想: 。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为bg,比较a,b关系
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。你认为合理的方案是 。
(3)研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示。你认为要测定上述红色沉淀成分必须测定下列哪些物理量: 。

①通入氢气体积;②反应前,红色沉淀+硬质玻璃管的总质量;③完全反应后红色固体+硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量
(4)研究性学习小组丙上网查阅新闻得知,"2005年诺贝尔化学奖授予了三位研究绿色化学的科学家"。绿色化学强调对环境友好,实现零排放。"变废为宝"符合绿色化学要求。他们收集上述红色沉淀制备化学试剂--蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案: 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三第一次阶段性诊断考试化学试卷 题型:填空题
(10分)胆矶(CuSO4•5H20)广泛用于电镀工艺,在医药上用做收敛剂、防腐剂和催吐剂。以下是用铜粉氧化法生产胆矾的流程图:
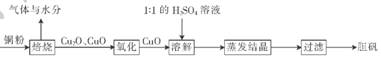
(1 )写出溶解过程中发生反应的离子方程式:____________
(2)1 :1的H2SO4溶液是由l体积98%的H2SO4与1体积水混合而成。配制该硫酸所需的硅酸盐质仪器除玻璃棒外.还需要______、______。
(3)已知氧化亚铜(Cu2O)与稀H2SO4反应有CuSO4和Cu生成。假设焙烧后固体只含铜的氧化物.为检验该固体的成分.下列实验设计合理的是__________________(填字母)。
A. 加人稀H2SO4,若溶液呈蓝色,说明固体中一定有CuO
B. 加人稀H2SO4,若有红色沉淀物生成,说明固体中一定有Cu2O
C. 加人稀HNO3,若有无色气体(随即变成红棕色:)产生,说明固体中有Cu2O
D. 加人稀HNO3,若固体全部溶解,说明固体中没有Cu2O
(4)取2.50g胆矶样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。
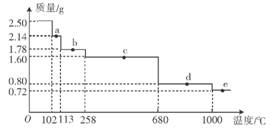
①a点时固体物质的化学式为______,c点时固体物质的化学式为______。
②10000C时发生反应的化学方程式为_________________________
查看答案和解析>>
科目:高中化学 来源:辽宁省模拟题 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com